+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | IAPP S20G growth-phase fibril polymorph 4PF-CU | |||||||||
 マップデータ マップデータ | CryoEM map for 6-week aged IAPP-S20G 4PF-CU fibrils | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード |  Amyloid (アミロイド) / Amyloid (アミロイド) /  fibril (フィブリル) / helical / cross-beta / fibril (フィブリル) / helical / cross-beta /  Amylin (アミリン (ホルモン)) / polymorph / islet / PROTEIN FIBRIL / Amylin (アミリン (ホルモン)) / polymorph / islet / PROTEIN FIBRIL /  Diabetes (糖尿病) Diabetes (糖尿病) | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報 : / amylin receptor signaling pathway / Calcitonin-like ligand receptors / negative regulation of amyloid fibril formation / negative regulation of bone resorption / : / amylin receptor signaling pathway / Calcitonin-like ligand receptors / negative regulation of amyloid fibril formation / negative regulation of bone resorption /  eating behavior / negative regulation of osteoclast differentiation / positive regulation of protein kinase A signaling / eating behavior / negative regulation of osteoclast differentiation / positive regulation of protein kinase A signaling /  Regulation of gene expression in beta cells / negative regulation of protein-containing complex assembly ... Regulation of gene expression in beta cells / negative regulation of protein-containing complex assembly ... : / amylin receptor signaling pathway / Calcitonin-like ligand receptors / negative regulation of amyloid fibril formation / negative regulation of bone resorption / : / amylin receptor signaling pathway / Calcitonin-like ligand receptors / negative regulation of amyloid fibril formation / negative regulation of bone resorption /  eating behavior / negative regulation of osteoclast differentiation / positive regulation of protein kinase A signaling / eating behavior / negative regulation of osteoclast differentiation / positive regulation of protein kinase A signaling /  Regulation of gene expression in beta cells / negative regulation of protein-containing complex assembly / positive regulation of cAMP-mediated signaling / positive regulation of calcium-mediated signaling / Regulation of gene expression in beta cells / negative regulation of protein-containing complex assembly / positive regulation of cAMP-mediated signaling / positive regulation of calcium-mediated signaling /  bone resorption / sensory perception of pain / osteoclast differentiation / bone resorption / sensory perception of pain / osteoclast differentiation /  hormone activity / cell-cell signaling / hormone activity / cell-cell signaling /  amyloid-beta binding / G alpha (s) signalling events / positive regulation of MAPK cascade / amyloid-beta binding / G alpha (s) signalling events / positive regulation of MAPK cascade /  receptor ligand activity / positive regulation of apoptotic process / Amyloid fiber formation / receptor ligand activity / positive regulation of apoptotic process / Amyloid fiber formation /  signaling receptor binding / apoptotic process / signaling receptor binding / apoptotic process /  lipid binding / lipid binding /  シグナル伝達 / シグナル伝達 /  extracellular space / extracellular region / identical protein binding extracellular space / extracellular region / identical protein binding類似検索 - 分子機能 | |||||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | らせん対称体再構成法 /  クライオ電子顕微鏡法 / 解像度: 3.4 Å クライオ電子顕微鏡法 / 解像度: 3.4 Å | |||||||||
 データ登録者 データ登録者 | Wilkinson M / Xu Y / Gallardo R / Radford SE / Ranson NA | |||||||||
| 資金援助 |  英国, 2件 英国, 2件
| |||||||||
 引用 引用 |  ジャーナル: Cell / 年: 2023 ジャーナル: Cell / 年: 2023タイトル: Structural evolution of fibril polymorphs during amyloid assembly. 著者: Martin Wilkinson / Yong Xu / Dev Thacker / Alexander I P Taylor / Declan G Fisher / Rodrigo U Gallardo / Sheena E Radford / Neil A Ranson /  要旨: Cryoelectron microscopy (cryo-EM) has provided unprecedented insights into amyloid fibril structures, including those associated with disease. However, these structures represent the endpoints of ...Cryoelectron microscopy (cryo-EM) has provided unprecedented insights into amyloid fibril structures, including those associated with disease. However, these structures represent the endpoints of long assembly processes, and their relationship to fibrils formed early in assembly is unknown. Consequently, whether different fibril architectures, with potentially different pathological properties, form during assembly remains unknown. Here, we used cryo-EM to determine structures of amyloid fibrils at different times during in vitro fibrillation of a disease-related variant of human islet amyloid polypeptide (IAPP-S20G). Strikingly, the fibrils formed in the lag, growth, and plateau phases have different structures, with new forms appearing and others disappearing as fibrillation proceeds. A time course with wild-type hIAPP also shows fibrils changing with time, suggesting that this is a general property of IAPP amyloid assembly. The observation of transiently populated fibril structures has implications for understanding amyloid assembly mechanisms with potential new insights into amyloid progression in disease. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_15731.map.gz emd_15731.map.gz | 8.4 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-15731-v30.xml emd-15731-v30.xml emd-15731.xml emd-15731.xml | 18.4 KB 18.4 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_15731.png emd_15731.png | 71.8 KB | ||
| Filedesc metadata |  emd-15731.cif.gz emd-15731.cif.gz | 5.6 KB | ||
| その他 |  emd_15731_half_map_1.map.gz emd_15731_half_map_1.map.gz emd_15731_half_map_2.map.gz emd_15731_half_map_2.map.gz | 96.5 MB 96.5 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-15731 http://ftp.pdbj.org/pub/emdb/structures/EMD-15731 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-15731 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-15731 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8az3MC  8awtC  8az0C  8az1C  8az2C  8az4C  8az5C  8az6C  8az7C C: 同じ文献を引用 ( M: このマップから作成された原子モデル |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_15731.map.gz / 形式: CCP4 / 大きさ: 103 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_15731.map.gz / 形式: CCP4 / 大きさ: 103 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | CryoEM map for 6-week aged IAPP-S20G 4PF-CU fibrils | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.84 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: halfmap1
| ファイル | emd_15731_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | halfmap1 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
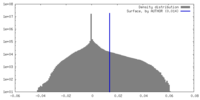
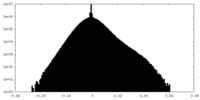
| 密度ヒストグラム |
-ハーフマップ: halfmap2
| ファイル | emd_15731_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | halfmap2 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
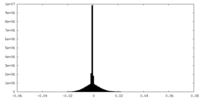
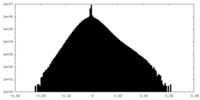
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : IAPP S20G growth-phase fibril polymorph 4PF-CU
| 全体 | 名称: IAPP S20G growth-phase fibril polymorph 4PF-CU |
|---|---|
| 要素 |
|
-超分子 #1: IAPP S20G growth-phase fibril polymorph 4PF-CU
| 超分子 | 名称: IAPP S20G growth-phase fibril polymorph 4PF-CU / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all 詳細: In vitro fibril growth for 6 weeks at room temperature |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: Islet amyloid polypeptide
| 分子 | 名称: Islet amyloid polypeptide / タイプ: protein_or_peptide / ID: 1 / 詳細: Synthesised with C-terminal amidation / コピー数: 20 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 3.877286 KDa |
| 配列 | 文字列: KCNTATCATQ RLANFLVHSG NNFGAILSST NVGSNTY(NH2) UniProtKB:  アミリン (ホルモン) アミリン (ホルモン) |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | らせん対称体再構成法 |
| 試料の集合状態 | filament |
- 試料調製
試料調製
| 濃度 | 0.12 mg/mL |
|---|---|
| 緩衝液 | pH: 6.8 / 構成要素 - 濃度: 20.0 mM / 構成要素 - 式: NH3CH3CO2 / 構成要素 - 名称: ammonium acetate |
| グリッド | モデル: EMS Lacey Carbon / 材質: COPPER / メッシュ: 300 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: LACEY / 前処理 - タイプ: PLASMA CLEANING / 前処理 - 時間: 60 sec. |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 90 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK IV / 詳細: 6s blot. |
| 詳細 | Fibrillation conditions: 30 uM monomeric IAPP-S20G, quiescent at room temp for 6 weeks |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 50.0 µm / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.5 µm / 最小 デフォーカス(公称値): 1.3 µm / 倍率(公称値): 96000 Bright-field microscopy / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.5 µm / 最小 デフォーカス(公称値): 1.3 µm / 倍率(公称値): 96000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER |
| 撮影 | フィルム・検出器のモデル: FEI FALCON IV (4k x 4k) 撮影したグリッド数: 1 / 実像数: 2350 / 平均露光時間: 5.0 sec. / 平均電子線量: 39.0 e/Å2 詳細: 1204 raw EER frames were collected per image and combined into 30 fractions for processing |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| Segment selection | 選択した数: 842792 詳細: Manually picked a subset of images to train a model for automatic fibril segment picking in crYOLO |
|---|---|
| 初期モデル | モデルのタイプ: INSILICO MODEL 詳細: Model generated from 2D class averages using relion_helix_inimodel2d |
| 最終 角度割当 | タイプ: NOT APPLICABLE / ソフトウェア - 名称: RELION (ver. 4.0) |
| 最終 再構成 | 想定した対称性 - らせんパラメータ - Δz: 2.4 Å 想定した対称性 - らせんパラメータ - ΔΦ: 179.11 ° 想定した対称性 - らせんパラメータ - 軸対称性: C1 (非対称) 解像度のタイプ: BY AUTHOR / 解像度: 3.4 Å / 解像度の算出法: FSC 0.143 CUT-OFF / ソフトウェア - 名称: RELION (ver. 4.0) / 使用した粒子像数: 6895 |
 ムービー
ムービー コントローラー
コントローラー















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)