+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-2984 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | 2.2 A resolution cryo-EM structure of beta-galactosidase in complex with a cell-permeant inhibitor | |||||||||
 マップデータ マップデータ | B-factor corrected reconstruction of PETG-bound beta-galactosidase. | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | near-atomic resolution cryo-electron microscopy / single-particle cryo-EM / protein complexes / PETG | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報alkali metal ion binding / lactose catabolic process / beta-galactosidase complex / beta-galactosidase / beta-galactosidase activity / carbohydrate binding / magnesium ion binding / identical protein binding 類似検索 - 分子機能 | |||||||||
| 生物種 |  | |||||||||
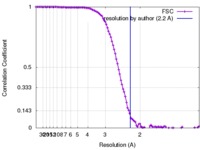
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.2 Å | |||||||||
 データ登録者 データ登録者 | Bartesaghi A / Merk A / Banerjee S / Matthies D / Wu X / Milne J / Subramaniam S | |||||||||
 引用 引用 |  ジャーナル: Science / 年: 2015 ジャーナル: Science / 年: 2015タイトル: 2.2 Å resolution cryo-EM structure of β-galactosidase in complex with a cell-permeant inhibitor. 著者: Alberto Bartesaghi / Alan Merk / Soojay Banerjee / Doreen Matthies / Xiongwu Wu / Jacqueline L S Milne / Sriram Subramaniam /  要旨: Cryo-electron microscopy (cryo-EM) is rapidly emerging as a powerful tool for protein structure determination at high resolution. Here we report the structure of a complex between Escherichia coli β- ...Cryo-electron microscopy (cryo-EM) is rapidly emerging as a powerful tool for protein structure determination at high resolution. Here we report the structure of a complex between Escherichia coli β-galactosidase and the cell-permeant inhibitor phenylethyl β-D-thiogalactopyranoside (PETG), determined by cryo-EM at an average resolution of ~2.2 angstroms (Å). Besides the PETG ligand, we identified densities in the map for ~800 water molecules and for magnesium and sodium ions. Although it is likely that continued advances in detector technology may further enhance resolution, our findings demonstrate that preparation of specimens of adequate quality and intrinsic protein flexibility, rather than imaging or image-processing technologies, now represent the major bottlenecks to routinely achieving resolutions close to 2 Å using single-particle cryo-EM. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_2984.map.gz emd_2984.map.gz | 86.8 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-2984-v30.xml emd-2984-v30.xml emd-2984.xml emd-2984.xml | 11.6 KB 11.6 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_2984_fsc.xml emd_2984_fsc.xml | 12.1 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd-2984-bgal2015_EMDB02.jpg emd-2984-bgal2015_EMDB02.jpg | 224.5 KB | ||
| その他 |  emd_2984_additional_1.map.gz emd_2984_additional_1.map.gz emd_2984_half_map_1.map.gz emd_2984_half_map_1.map.gz emd_2984_half_map_2.map.gz emd_2984_half_map_2.map.gz | 87.3 MB 87.9 MB 87.9 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-2984 http://ftp.pdbj.org/pub/emdb/structures/EMD-2984 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-2984 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-2984 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_2984_validation.pdf.gz emd_2984_validation.pdf.gz | 422.4 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_2984_full_validation.pdf.gz emd_2984_full_validation.pdf.gz | 421.5 KB | 表示 | |
| XML形式データ |  emd_2984_validation.xml.gz emd_2984_validation.xml.gz | 11.6 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-2984 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-2984 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-2984 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-2984 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  5a1aMC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | |
| 電子顕微鏡画像生データ |  EMPIAR-10061 (タイトル: 2.2 A resolution cryo-EM structure of beta-galactosidase in complex with a cell-permeant inhibitor EMPIAR-10061 (タイトル: 2.2 A resolution cryo-EM structure of beta-galactosidase in complex with a cell-permeant inhibitorData size: 12.4 TB Data #1: Averages of aligned movie frames [micrographs - single frame] Data #2: Raw movie frames [micrographs - multiframe]) |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_2984.map.gz / 形式: CCP4 / 大きさ: 92.8 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_2984.map.gz / 形式: CCP4 / 大きさ: 92.8 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | B-factor corrected reconstruction of PETG-bound beta-galactosidase. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.637 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
-添付マップデータ: emd 2984 additional 1.map
| ファイル | emd_2984_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-添付マップデータ: emd 2984 half map 1.map
| ファイル | emd_2984_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-添付マップデータ: emd 2984 half map 2.map
| ファイル | emd_2984_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Escherichia coli beta-galactosidase bound to phenylethyl beta-D-t...
| 全体 | 名称: Escherichia coli beta-galactosidase bound to phenylethyl beta-D-thiogalactopyranoside (PETG) |
|---|---|
| 要素 |
|
-超分子 #1000: Escherichia coli beta-galactosidase bound to phenylethyl beta-D-t...
| 超分子 | 名称: Escherichia coli beta-galactosidase bound to phenylethyl beta-D-thiogalactopyranoside (PETG) タイプ: sample / ID: 1000 / 詳細: The sample was monodisperse. / 集合状態: tetramer / Number unique components: 2 |
|---|---|
| 分子量 | 理論値: 465 KDa 手法: ProtParam tool: Gasteiger E., Hoogland C., Gattiker A., Duvaud S., Wilkins M.R., Appel R.D., Bairoch A., Protein Identification and Analysis Tools on the ExPASy Server, (in) John M. Walker ...手法: ProtParam tool: Gasteiger E., Hoogland C., Gattiker A., Duvaud S., Wilkins M.R., Appel R.D., Bairoch A., Protein Identification and Analysis Tools on the ExPASy Server, (in) John M. Walker (ed): The Proteomics Protocols Handbook, Humana Press (2005), pp. 571-607 |
-分子 #1: beta-galactosidase
| 分子 | 名称: beta-galactosidase / タイプ: protein_or_peptide / ID: 1 / Name.synonym: beta-gal, b-gal / コピー数: 1 / 集合状態: tetramer / 組換発現: No |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 465 KDa |
| 配列 | UniProtKB: Beta-galactosidase / GO: beta-galactosidase activity |
-分子 #2: phenylethyl beta-D-thiogalactopyranoside
| 分子 | 名称: phenylethyl beta-D-thiogalactopyranoside / タイプ: ligand / ID: 2 / Name.synonym: PETG / 詳細: Molecular weight of PETG is 300.37 Da. / コピー数: 4 / 集合状態: monomer / 組換発現: No |
|---|---|
| 由来(天然) | 生物種: unidentified (未定義) |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 2.3 mg/mL |
|---|---|
| 緩衝液 | pH: 8 詳細: 25 mM Tris, pH 8.0, 50 mM NaCl, 2 mM MgCl2, 1.0 mM TCEP |
| グリッド | 詳細: 200 mesh Quantifoil R2/2 grids, plasma cleaned |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 90 % / チャンバー内温度: 90.15 K / 装置: LEICA EM GP / 手法: Blot for 2 seconds before plunging. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 温度 | 最低: 79.6 K / 最高: 79.8 K / 平均: 79.7 K |
| アライメント法 | Legacy - 非点収差: Objective lens astigmatism was corrected at 215,000 times magnification. |
| 特殊光学系 | エネルギーフィルター - 名称: Gatan, Inc. エネルギーフィルター - エネルギー下限: 0.0 eV エネルギーフィルター - エネルギー上限: 20.0 eV |
| 詳細 | Parallel beam illumination |
| 日付 | 2014年12月15日 |
| 撮影 | カテゴリ: CCD / フィルム・検出器のモデル: GATAN K2 (4k x 4k) / 実像数: 1487 / 平均電子線量: 45 e/Å2 詳細: Every image is the average of 38 frames recorded by the direct electron detector. |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 倍率(補正後): 215000 / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 0.6 µm / 倍率(公称値): 215000 |
| 試料ステージ | 試料ホルダー: Liquid nitrogen cooled 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー













 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)