+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Complex I from E. coli, LMNG-purified, under Turnover at pH 6, Resting state NADH:ユビキノン還元酵素 (水素イオン輸送型) NADH:ユビキノン還元酵素 (水素イオン輸送型) | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報 NADH dehydrogenase complex / NADH dehydrogenase complex /  oxidoreductase complex / トランスロカーゼ; ヒドロンの輸送の触媒; 酸化還元酵素反応を伴う / NADH:ubiquinone reductase (non-electrogenic) activity / respiratory chain complex I / molybdopterin cofactor binding / oxidoreductase activity, acting on NAD(P)H, quinone or similar compound as acceptor / oxidoreductase complex / トランスロカーゼ; ヒドロンの輸送の触媒; 酸化還元酵素反応を伴う / NADH:ubiquinone reductase (non-electrogenic) activity / respiratory chain complex I / molybdopterin cofactor binding / oxidoreductase activity, acting on NAD(P)H, quinone or similar compound as acceptor /  NADH dehydrogenase (ubiquinone) activity / NADH dehydrogenase (ubiquinone) activity /  quinone binding / ATP synthesis coupled electron transport ... quinone binding / ATP synthesis coupled electron transport ... NADH dehydrogenase complex / NADH dehydrogenase complex /  oxidoreductase complex / トランスロカーゼ; ヒドロンの輸送の触媒; 酸化還元酵素反応を伴う / NADH:ubiquinone reductase (non-electrogenic) activity / respiratory chain complex I / molybdopterin cofactor binding / oxidoreductase activity, acting on NAD(P)H, quinone or similar compound as acceptor / oxidoreductase complex / トランスロカーゼ; ヒドロンの輸送の触媒; 酸化還元酵素反応を伴う / NADH:ubiquinone reductase (non-electrogenic) activity / respiratory chain complex I / molybdopterin cofactor binding / oxidoreductase activity, acting on NAD(P)H, quinone or similar compound as acceptor /  NADH dehydrogenase (ubiquinone) activity / NADH dehydrogenase (ubiquinone) activity /  quinone binding / ATP synthesis coupled electron transport / 2 iron, 2 sulfur cluster binding / NAD binding / FMN binding / 4 iron, 4 sulfur cluster binding / quinone binding / ATP synthesis coupled electron transport / 2 iron, 2 sulfur cluster binding / NAD binding / FMN binding / 4 iron, 4 sulfur cluster binding /  oxidoreductase activity / iron ion binding / oxidoreductase activity / iron ion binding /  生体膜 / 生体膜 /  metal ion binding / metal ion binding /  細胞膜 細胞膜類似検索 - 分子機能 | |||||||||
| 生物種 |   Escherichia coli (大腸菌) Escherichia coli (大腸菌) | |||||||||
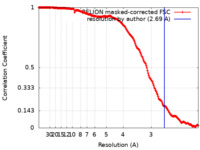
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 2.69 Å クライオ電子顕微鏡法 / 解像度: 2.69 Å | |||||||||
 データ登録者 データ登録者 | Kravchuk V / Kampjut D / Sazanov L | |||||||||
| 資金援助 |  オーストリア, 1件 オーストリア, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nature / 年: 2022 ジャーナル: Nature / 年: 2022タイトル: A universal coupling mechanism of respiratory complex I. 著者: Vladyslav Kravchuk / Olga Petrova / Domen Kampjut / Anna Wojciechowska-Bason / Zara Breese / Leonid Sazanov /    要旨: Complex I is the first enzyme in the respiratory chain, which is responsible for energy production in mitochondria and bacteria. Complex I couples the transfer of two electrons from NADH to quinone ...Complex I is the first enzyme in the respiratory chain, which is responsible for energy production in mitochondria and bacteria. Complex I couples the transfer of two electrons from NADH to quinone and the translocation of four protons across the membrane, but the coupling mechanism remains contentious. Here we present cryo-electron microscopy structures of Escherichia coli complex I (EcCI) in different redox states, including catalytic turnover. EcCI exists mostly in the open state, in which the quinone cavity is exposed to the cytosol, allowing access for water molecules, which enable quinone movements. Unlike the mammalian paralogues, EcCI can convert to the closed state only during turnover, showing that closed and open states are genuine turnover intermediates. The open-to-closed transition results in the tightly engulfed quinone cavity being connected to the central axis of the membrane arm, a source of substrate protons. Consistently, the proportion of the closed state increases with increasing pH. We propose a detailed but straightforward and robust mechanism comprising a 'domino effect' series of proton transfers and electrostatic interactions: the forward wave ('dominoes stacking') primes the pump, and the reverse wave ('dominoes falling') results in the ejection of all pumped protons from the distal subunit NuoL. This mechanism explains why protons exit exclusively from the NuoL subunit and is supported by our mutagenesis data. We contend that this is a universal coupling mechanism of complex I and related enzymes. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_14632.map.gz emd_14632.map.gz | 2.7 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-14632-v30.xml emd-14632-v30.xml emd-14632.xml emd-14632.xml | 35.9 KB 35.9 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_14632_fsc.xml emd_14632_fsc.xml | 17.7 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_14632.png emd_14632.png | 70.5 KB | ||
| その他 |  emd_14632_additional_1.map.gz emd_14632_additional_1.map.gz emd_14632_additional_2.map.gz emd_14632_additional_2.map.gz | 274.1 MB 274 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-14632 http://ftp.pdbj.org/pub/emdb/structures/EMD-14632 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-14632 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-14632 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  7zciMC  7p61C  7p62C  7p63C  7p64C  7p69C  7p7cC  7p7eC  7p7jC  7p7kC  7p7lC  7p7mC  7z7rC  7z7sC  7z7tC  7z7vC  7z80C  7z83C  7z84C  7zc5C  7zd6C  7zdhC  7zdjC  7zdmC  7zdpC  7zebC C: 同じ文献を引用 ( M: このマップから作成された原子モデル |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_14632.map.gz / 形式: CCP4 / 大きさ: 24.6 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_14632.map.gz / 形式: CCP4 / 大きさ: 24.6 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 これらの図は立方格子座標系で作成されたものです | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.06 Å | ||||||||||||||||||||||||||||||||||||
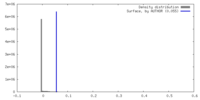
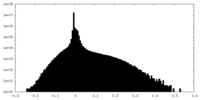
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-追加マップ: MD focused map
| ファイル | emd_14632_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | MD focused map | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-追加マップ: PA focused map
| ファイル | emd_14632_additional_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | PA focused map | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
+全体 : Complex I
+超分子 #1: Complex I
+分子 #1: NADH-quinone oxidoreductase subunit F
+分子 #2: NADH dehydrogenase I subunit E
+分子 #3: NADH-quinone oxidoreductase
+分子 #4: NADH-quinone oxidoreductase subunit C/D
+分子 #5: NADH-quinone oxidoreductase subunit B
+分子 #6: NADH-quinone oxidoreductase subunit I
+分子 #7: NADH-quinone oxidoreductase subunit H
+分子 #8: NADH-quinone oxidoreductase subunit A
+分子 #9: NADH dehydrogenase subunit L
+分子 #10: NADH dehydrogenase I subunit M
+分子 #11: NADH-quinone oxidoreductase subunit N
+分子 #12: NADH-quinone oxidoreductase subunit K
+分子 #13: NADH-quinone oxidoreductase subunit J
+分子 #14: IRON/SULFUR CLUSTER
+分子 #15: FLAVIN MONONUCLEOTIDE
+分子 #16: 1,4-DIHYDRONICOTINAMIDE ADENINE DINUCLEOTIDE
+分子 #17: FE2/S2 (INORGANIC) CLUSTER
+分子 #18: CALCIUM ION
+分子 #19: EICOSANE
+分子 #20: 1,2-Distearoyl-sn-glycerophosphoethanolamine
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.25 mg/mL | |||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 6 構成要素:
| |||||||||||||||||||||||||||
| グリッド | モデル: Quantifoil R0.6/1 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: CONTINUOUS / 支持フィルム - Film thickness: 0.9 nm / 前処理 - タイプ: GLOW DISCHARGE | |||||||||||||||||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 288 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 100.0 µm / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 1.0 µm / 倍率(公称値): 81000 Bright-field microscopy / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 1.0 µm / 倍率(公称値): 81000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / デジタル化 - サンプリング間隔: 5.0 µm / 撮影したグリッド数: 1 / 実像数: 11316 / 平均電子線量: 80.0 e/Å2 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー























































































 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)