+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-21501 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Amyloid-beta(1-40) fibril derived from Alzheimer's disease cortical tissue | |||||||||
 マップデータ マップデータ | CryoEM density map from RELION-based analysis | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード |  amyloid-beta (アミロイドβ) / amyloid-beta (アミロイドβ) /  Alzheimer's disease (アルツハイマー病) / PROTEIN FIBRIL Alzheimer's disease (アルツハイマー病) / PROTEIN FIBRIL | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報regulation of epidermal growth factor-activated receptor activity / signaling receptor activator activity / cytosolic mRNA polyadenylation / collateral sprouting in absence of injury / microglia development / regulation of synapse structure or activity / Formyl peptide receptors bind formyl peptides and many other ligands /  regulation of Wnt signaling pathway / axo-dendritic transport / synaptic assembly at neuromuscular junction ...regulation of epidermal growth factor-activated receptor activity / signaling receptor activator activity / cytosolic mRNA polyadenylation / collateral sprouting in absence of injury / microglia development / regulation of synapse structure or activity / Formyl peptide receptors bind formyl peptides and many other ligands / regulation of Wnt signaling pathway / axo-dendritic transport / synaptic assembly at neuromuscular junction ...regulation of epidermal growth factor-activated receptor activity / signaling receptor activator activity / cytosolic mRNA polyadenylation / collateral sprouting in absence of injury / microglia development / regulation of synapse structure or activity / Formyl peptide receptors bind formyl peptides and many other ligands /  regulation of Wnt signaling pathway / axo-dendritic transport / synaptic assembly at neuromuscular junction / smooth endoplasmic reticulum calcium ion homeostasis / axon midline choice point recognition / astrocyte activation involved in immune response / regulation of spontaneous synaptic transmission / mating behavior / NMDA selective glutamate receptor signaling pathway / regulation of Wnt signaling pathway / axo-dendritic transport / synaptic assembly at neuromuscular junction / smooth endoplasmic reticulum calcium ion homeostasis / axon midline choice point recognition / astrocyte activation involved in immune response / regulation of spontaneous synaptic transmission / mating behavior / NMDA selective glutamate receptor signaling pathway /  繊毛 / Lysosome Vesicle Biogenesis / 繊毛 / Lysosome Vesicle Biogenesis /  PTB domain binding / Golgi-associated vesicle / positive regulation of amyloid fibril formation / neuron remodeling / Insertion of tail-anchored proteins into the endoplasmic reticulum membrane / protein serine/threonine kinase binding / Deregulated CDK5 triggers multiple neurodegenerative pathways in Alzheimer's disease models / : / nuclear envelope lumen / suckling behavior / presynaptic active zone / dendrite development / COPII-coated ER to Golgi transport vesicle / modulation of excitatory postsynaptic potential / TRAF6 mediated NF-kB activation / Advanced glycosylation endproduct receptor signaling / neuromuscular process controlling balance / The NLRP3 inflammasome / regulation of presynapse assembly / transition metal ion binding / regulation of multicellular organism growth / intracellular copper ion homeostasis / negative regulation of long-term synaptic potentiation / negative regulation of neuron differentiation / ECM proteoglycans / PTB domain binding / Golgi-associated vesicle / positive regulation of amyloid fibril formation / neuron remodeling / Insertion of tail-anchored proteins into the endoplasmic reticulum membrane / protein serine/threonine kinase binding / Deregulated CDK5 triggers multiple neurodegenerative pathways in Alzheimer's disease models / : / nuclear envelope lumen / suckling behavior / presynaptic active zone / dendrite development / COPII-coated ER to Golgi transport vesicle / modulation of excitatory postsynaptic potential / TRAF6 mediated NF-kB activation / Advanced glycosylation endproduct receptor signaling / neuromuscular process controlling balance / The NLRP3 inflammasome / regulation of presynapse assembly / transition metal ion binding / regulation of multicellular organism growth / intracellular copper ion homeostasis / negative regulation of long-term synaptic potentiation / negative regulation of neuron differentiation / ECM proteoglycans /  小胞体 / 小胞体 /  Mitochondrial protein degradation / positive regulation of T cell migration / spindle midzone / Mitochondrial protein degradation / positive regulation of T cell migration / spindle midzone /  Purinergic signaling in leishmaniasis infection / positive regulation of calcium-mediated signaling / Purinergic signaling in leishmaniasis infection / positive regulation of calcium-mediated signaling /  クラスリン / regulation of peptidyl-tyrosine phosphorylation / positive regulation of chemokine production / forebrain development / クラスリン / regulation of peptidyl-tyrosine phosphorylation / positive regulation of chemokine production / forebrain development /  Notchシグナリング / positive regulation of G2/M transition of mitotic cell cycle / neuron projection maintenance / positive regulation of protein metabolic process / ionotropic glutamate receptor signaling pathway / positive regulation of glycolytic process / cholesterol metabolic process / response to interleukin-1 / positive regulation of mitotic cell cycle / extracellular matrix organization / Notchシグナリング / positive regulation of G2/M transition of mitotic cell cycle / neuron projection maintenance / positive regulation of protein metabolic process / ionotropic glutamate receptor signaling pathway / positive regulation of glycolytic process / cholesterol metabolic process / response to interleukin-1 / positive regulation of mitotic cell cycle / extracellular matrix organization /  軸索誘導 / adult locomotory behavior / trans-Golgi network membrane / platelet alpha granule lumen / locomotory behavior / positive regulation of peptidyl-threonine phosphorylation / dendritic shaft / 軸索誘導 / adult locomotory behavior / trans-Golgi network membrane / platelet alpha granule lumen / locomotory behavior / positive regulation of peptidyl-threonine phosphorylation / dendritic shaft /  学習 / positive regulation of interleukin-1 beta production / 学習 / positive regulation of interleukin-1 beta production /  central nervous system development / positive regulation of long-term synaptic potentiation / endosome lumen / astrocyte activation / central nervous system development / positive regulation of long-term synaptic potentiation / endosome lumen / astrocyte activation /  Post-translational protein phosphorylation / positive regulation of JNK cascade / synapse organization / regulation of long-term neuronal synaptic plasticity / microglial cell activation / TAK1-dependent IKK and NF-kappa-B activation / Post-translational protein phosphorylation / positive regulation of JNK cascade / synapse organization / regulation of long-term neuronal synaptic plasticity / microglial cell activation / TAK1-dependent IKK and NF-kappa-B activation /  visual learning / serine-type endopeptidase inhibitor activity / visual learning / serine-type endopeptidase inhibitor activity /  neuromuscular junction / recycling endosome / neuromuscular junction / recycling endosome /  認識 / positive regulation of inflammatory response / Golgi lumen / neuron cellular homeostasis / 認識 / positive regulation of inflammatory response / Golgi lumen / neuron cellular homeostasis /  エンドサイトーシス / positive regulation of non-canonical NF-kappaB signal transduction / cellular response to amyloid-beta / positive regulation of interleukin-6 production / Regulation of Insulin-like Growth Factor (IGF) transport and uptake by Insulin-like Growth Factor Binding Proteins (IGFBPs) / neuron projection development / G2/M transition of mitotic cell cycle / positive regulation of tumor necrosis factor production / cell-cell junction / エンドサイトーシス / positive regulation of non-canonical NF-kappaB signal transduction / cellular response to amyloid-beta / positive regulation of interleukin-6 production / Regulation of Insulin-like Growth Factor (IGF) transport and uptake by Insulin-like Growth Factor Binding Proteins (IGFBPs) / neuron projection development / G2/M transition of mitotic cell cycle / positive regulation of tumor necrosis factor production / cell-cell junction /  シナプス小胞 シナプス小胞類似検索 - 分子機能 | |||||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | らせん対称体再構成法 /  クライオ電子顕微鏡法 / 解像度: 2.77 Å クライオ電子顕微鏡法 / 解像度: 2.77 Å | |||||||||
 データ登録者 データ登録者 | Ghosh U / Thurber KR | |||||||||
 引用 引用 |  ジャーナル: Proc Natl Acad Sci U S A / 年: 2021 ジャーナル: Proc Natl Acad Sci U S A / 年: 2021タイトル: Molecular structure of a prevalent amyloid-β fibril polymorph from Alzheimer's disease brain tissue. 著者: Ujjayini Ghosh / Kent R Thurber / Wai-Ming Yau / Robert Tycko /  要旨: Amyloid-β (Aβ) fibrils exhibit self-propagating, molecular-level polymorphisms that may contribute to variations in clinical and pathological characteristics of Alzheimer's disease (AD). We report ...Amyloid-β (Aβ) fibrils exhibit self-propagating, molecular-level polymorphisms that may contribute to variations in clinical and pathological characteristics of Alzheimer's disease (AD). We report the molecular structure of a specific fibril polymorph, formed by 40-residue Aβ peptides (Aβ40), that is derived from cortical tissue of an AD patient by seeded fibril growth. The structure is determined from cryogenic electron microscopy (cryoEM) images, supplemented by mass-per-length (MPL) measurements and solid-state NMR (ssNMR) data. Previous ssNMR studies with multiple AD patients had identified this polymorph as the most prevalent brain-derived Aβ40 fibril polymorph from typical AD patients. The structure, which has 2.8-Å resolution according to standard criteria, differs qualitatively from all previously described Aβ fibril structures, both in its molecular conformations and its organization of cross-β subunits. Unique features include twofold screw symmetry about the fibril growth axis, despite an MPL value that indicates three Aβ40 molecules per 4.8-Å β-sheet spacing, a four-layered architecture, and fully extended conformations for molecules in the central two cross-β layers. The cryoEM density, ssNMR data, and MPL data are consistent with β-hairpin conformations for molecules in the outer cross-β layers. Knowledge of this brain-derived fibril structure may contribute to the development of structure-specific amyloid imaging agents and aggregation inhibitors with greater diagnostic and therapeutic utility. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_21501.map.gz emd_21501.map.gz | 224.1 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-21501-v30.xml emd-21501-v30.xml emd-21501.xml emd-21501.xml | 14.3 KB 14.3 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
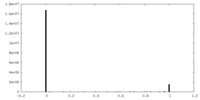
| FSC (解像度算出) |  emd_21501_fsc.xml emd_21501_fsc.xml | 14.1 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_21501.png emd_21501.png | 120.4 KB | ||
| マスクデータ |  emd_21501_msk_1.map emd_21501_msk_1.map | 244.1 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-21501.cif.gz emd-21501.cif.gz | 6.1 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-21501 http://ftp.pdbj.org/pub/emdb/structures/EMD-21501 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-21501 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-21501 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_21501.map.gz / 形式: CCP4 / 大きさ: 244.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_21501.map.gz / 形式: CCP4 / 大きさ: 244.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | CryoEM density map from RELION-based analysis | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.08 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
-マスク #1
| ファイル |  emd_21501_msk_1.map emd_21501_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
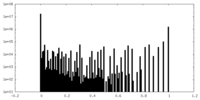
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : amyloid-beta(1-40) fibrils derived from human AD brain
| 全体 | 名称: amyloid-beta(1-40) fibrils derived from human AD brain |
|---|---|
| 要素 |
|
-超分子 #1: amyloid-beta(1-40) fibrils derived from human AD brain
| 超分子 | 名称: amyloid-beta(1-40) fibrils derived from human AD brain タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all 詳細: Fibrils produced by seeded growth using amyloid-beta in brain extract as the source of seeds. CryoEM and solid state NMR measurements were performed on second-generation seeded fibrils. |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 29 kDa/nm |
-分子 #1: Amyloid-beta precursor protein
| 分子 | 名称: Amyloid-beta precursor protein / タイプ: protein_or_peptide / ID: 1 / コピー数: 6 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 4.335852 KDa |
| 配列 | 文字列: DAEFRHDSGY EVHHQKLVFF AEDVGSNKGA IIGLMVGGVV UniProtKB:  アミロイド前駆体タンパク質 アミロイド前駆体タンパク質 |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | らせん対称体再構成法 |
| 試料の集合状態 | filament |
- 試料調製
試料調製
| 濃度 | 0.45 mg/mL |
|---|---|
| 緩衝液 | pH: 7.4 / 構成要素 - 濃度: 10.0 mM / 構成要素 - 式: Na2HPO4/NaH2PO4 / 構成要素 - 名称: Phosphate buffer 詳細: 10 mM phosphate buffer with 0.01% NaN3 to avoid microbial contamination. Buffers were filtered to avoid contamination. |
| グリッド | モデル: Quantifoil R1.2/1.3 / 材質: GOLD / メッシュ: 300 / 支持フィルム - トポロジー: HOLEY / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 60 sec. / 前処理 - 雰囲気: OTHER / 前処理 - 気圧: 0.036000000000000004 kPa / 詳細: The grids were checked in microscope prior to use. |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 90 % / チャンバー内温度: 293 K / 装置: LEICA PLUNGER 詳細: The grids were preblotted for 10 seconds and blotted for 6 seconds before plunging.. |
| 詳細 | Protein exists in solution as amyloid fibrils of varying lengths. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | TFS KRIOS |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 100.0 µm / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy / Cs: 2.7 mm / 最大 デフォーカス(公称値): -3.0 µm / 最小 デフォーカス(公称値): -0.5 µm / 倍率(公称値): 130000 Bright-field microscopy / Cs: 2.7 mm / 最大 デフォーカス(公称値): -3.0 µm / 最小 デフォーカス(公称値): -0.5 µm / 倍率(公称値): 130000 |
| 特殊光学系 | エネルギーフィルター - 名称: GIF Quantum LS / エネルギーフィルター - スリット幅: 20 eV |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| アライメント法 | Coma free - Residual tilt: 6.0 mrad |
| 詳細 | Preliminary grid screening was done manually in FEI T12. |
| 撮影 | フィルム・検出器のモデル: GATAN K2 QUANTUM (4k x 4k) 検出モード: SUPER-RESOLUTION / デジタル化 - 画像ごとのフレーム数: 1-50 / 撮影したグリッド数: 1 / 実像数: 1337 / 平均露光時間: 10.0 sec. / 平均電子線量: 73.5 e/Å2 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
-原子モデル構築 1
| 詳細 | Xplor-NIH was used to combine EM density with phi/psi restraints from NMR chemical shifts (from Talos-N Version 4.21 Rev 2016.343.11.31). |
|---|---|
| 精密化 | 空間: REAL / プロトコル: AB INITIO MODEL |
| 得られたモデル |  PDB-6w0o: |
 ムービー
ムービー コントローラー
コントローラー




















 Z
Z Y
Y X
X