[English] 日本語
 Yorodumi
Yorodumi- PDB-9vgz: SIRT2-F96A structure in complex with H3K18myr peptide and native NAD -
+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 9vgz | ||||||
|---|---|---|---|---|---|---|---|
| Title | SIRT2-F96A structure in complex with H3K18myr peptide and native NAD | ||||||
 Components Components |
| ||||||
 Keywords Keywords | HYDROLASE / Deacylated / cell cycle regulation / Metabolic regulation | ||||||
| Function / homology |  Function and homology information Function and homology informationcellular response to caloric restriction / negative regulation of oligodendrocyte progenitor proliferation / negative regulation of striated muscle tissue development / negative regulation of satellite cell differentiation / histone H4K16 deacetylase activity, NAD-dependent / positive regulation of attachment of spindle microtubules to kinetochore / positive regulation of meiotic nuclear division / NAD-dependent protein demyristoylase activity / NAD-dependent protein depalmitoylase activity / paranodal junction ...cellular response to caloric restriction / negative regulation of oligodendrocyte progenitor proliferation / negative regulation of striated muscle tissue development / negative regulation of satellite cell differentiation / histone H4K16 deacetylase activity, NAD-dependent / positive regulation of attachment of spindle microtubules to kinetochore / positive regulation of meiotic nuclear division / NAD-dependent protein demyristoylase activity / NAD-dependent protein depalmitoylase activity / paranodal junction / tubulin deacetylation / peptidyl-lysine deacetylation / lateral loop / NLRP3 inflammasome complex assembly / mitotic nuclear membrane reassembly / tubulin deacetylase activity / negative regulation of NLRP3 inflammasome complex assembly / paranode region of axon / regulation of exit from mitosis / Schmidt-Lanterman incisure / negative regulation of peptidyl-threonine phosphorylation / positive regulation of fatty acid biosynthetic process / NAD-dependent protein lysine deacetylase activity / regulation of phosphorylation / protein acetyllysine N-acetyltransferase / myelination in peripheral nervous system / rDNA heterochromatin formation / protein deacetylation / histone deacetylase activity, NAD-dependent / positive regulation of oocyte maturation / juxtaparanode region of axon / Initiation of Nuclear Envelope (NE) Reformation / chromatin silencing complex / meiotic spindle / protein lysine deacetylase activity / histone deacetylase activity / regulation of myelination / response to redox state / positive regulation of DNA binding / histone acetyltransferase binding / negative regulation of fat cell differentiation / negative regulation of reactive oxygen species metabolic process / positive regulation of cell division / NAD+ poly-ADP-ribosyltransferase activity / NAD+ binding / glial cell projection / positive regulation of execution phase of apoptosis / subtelomeric heterochromatin formation / heterochromatin / lipid catabolic process / Chromatin modifying enzymes / Transferases; Acyltransferases; Transferring groups other than aminoacyl groups / centriole / cellular response to epinephrine stimulus / substantia nigra development / negative regulation of autophagy / telomere organization / Interleukin-7 signaling / RNA Polymerase I Promoter Opening / epigenetic regulation of gene expression / Assembly of the ORC complex at the origin of replication / Regulation of endogenous retroelements by the Human Silencing Hub (HUSH) complex / ubiquitin binding / DNA methylation / Condensation of Prophase Chromosomes / Chromatin modifications during the maternal to zygotic transition (MZT) / SIRT1 negatively regulates rRNA expression / HCMV Late Events / ERCC6 (CSB) and EHMT2 (G9a) positively regulate rRNA expression / PRC2 methylates histones and DNA / Regulation of endogenous retroelements by KRAB-ZFP proteins / Defective pyroptosis / meiotic cell cycle / HDACs deacetylate histones / Regulation of endogenous retroelements by Piwi-interacting RNAs (piRNAs) / RNA Polymerase I Promoter Escape / Transcriptional regulation by small RNAs / Formation of the beta-catenin:TCF transactivating complex / Activated PKN1 stimulates transcription of AR (androgen receptor) regulated genes KLK2 and KLK3 / RUNX1 regulates genes involved in megakaryocyte differentiation and platelet function / HDMs demethylate histones / negative regulation of protein catabolic process / NoRC negatively regulates rRNA expression / B-WICH complex positively regulates rRNA expression / PKMTs methylate histone lysines / autophagy / Pre-NOTCH Transcription and Translation / Meiotic recombination / histone deacetylase binding / Activation of anterior HOX genes in hindbrain development during early embryogenesis / spindle / RMTs methylate histone arginines / Transcriptional regulation of granulopoiesis / HCMV Early Events / mitotic spindle / structural constituent of chromatin / heterochromatin formation / nucleosome / positive regulation of proteasomal ubiquitin-dependent protein catabolic process / myelin sheath Similarity search - Function | ||||||
| Biological species |  Homo sapiens (human) Homo sapiens (human) | ||||||
| Method |  X-RAY DIFFRACTION / X-RAY DIFFRACTION /  SYNCHROTRON / SYNCHROTRON /  MOLECULAR REPLACEMENT / Resolution: 2.34 Å MOLECULAR REPLACEMENT / Resolution: 2.34 Å | ||||||
 Authors Authors | Zhang, N. / Hao, Q. | ||||||
| Funding support |  China, 1items China, 1items
| ||||||
 Citation Citation |  Journal: Rsc Chem Biol / Year: 2025 Journal: Rsc Chem Biol / Year: 2025Title: Structural basis of SIRT2 pre-catalysis NAD + binding dynamics and mechanism. Authors: Zhang, N. / Pow, K.C. / Chen, L. / Hao, Q. | ||||||
| History |
|
- Structure visualization
Structure visualization
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  9vgz.cif.gz 9vgz.cif.gz | 167.4 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb9vgz.ent.gz pdb9vgz.ent.gz | 106.1 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  9vgz.json.gz 9vgz.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/vg/9vgz https://data.pdbj.org/pub/pdb/validation_reports/vg/9vgz ftp://data.pdbj.org/pub/pdb/validation_reports/vg/9vgz ftp://data.pdbj.org/pub/pdb/validation_reports/vg/9vgz | HTTPS FTP |
|---|
-Related structure data
| Related structure data |  9v7wC  9vemSC  9vewC  9vg0C  9vg3C  9vgeC  9vh0C S: Starting model for refinement C: citing same article ( |
|---|---|
| Similar structure data | Similarity search - Function & homology  F&H Search F&H Search |
- Links
Links
- Assembly
Assembly
| Deposited unit | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| Unit cell |
|
- Components
Components
-Protein / Protein/peptide , 2 types, 2 molecules AC
| #1: Protein | Mass: 34615.906 Da / Num. of mol.: 1 / Mutation: F96A Source method: isolated from a genetically manipulated source Source: (gene. exp.)  Homo sapiens (human) / Gene: SIRT2, SIR2L, SIR2L2 / Production host: Homo sapiens (human) / Gene: SIRT2, SIR2L, SIR2L2 / Production host:  References: UniProt: Q8IXJ6, protein acetyllysine N-acetyltransferase, Transferases; Acyltransferases; Transferring groups other than aminoacyl groups |
|---|---|
| #2: Protein/peptide | Mass: 784.946 Da / Num. of mol.: 1 / Source method: obtained synthetically / Source: (synth.)  Homo sapiens (human) / References: UniProt: P68431 Homo sapiens (human) / References: UniProt: P68431 |
-Non-polymers , 6 types, 50 molecules 



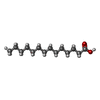






| #3: Chemical | ChemComp-NAD / |
|---|---|
| #4: Chemical | ChemComp-EDO / |
| #5: Chemical | ChemComp-PEG / |
| #6: Chemical | ChemComp-ZN / |
| #7: Chemical | ChemComp-MYR / |
| #8: Water | ChemComp-HOH / |
-Details
| Has ligand of interest | Y |
|---|---|
| Has protein modification | Y |
-Experimental details
-Experiment
| Experiment | Method:  X-RAY DIFFRACTION / Number of used crystals: 1 X-RAY DIFFRACTION / Number of used crystals: 1 |
|---|
- Sample preparation
Sample preparation
| Crystal | Density Matthews: 2.31 Å3/Da / Density % sol: 46.67 % |
|---|---|
| Crystal grow | Temperature: 289 K / Method: vapor diffusion, sitting drop / pH: 8 / Details: Tris 8.0, 25% PEG 2000MME |
-Data collection
| Diffraction | Mean temperature: 100 K / Serial crystal experiment: N |
|---|---|
| Diffraction source | Source:  SYNCHROTRON / Site: SYNCHROTRON / Site:  SSRF SSRF  / Beamline: BL10U2 / Wavelength: 0.97918 Å / Beamline: BL10U2 / Wavelength: 0.97918 Å |
| Detector | Type: DECTRIS EIGER X 16M / Detector: PIXEL / Date: Dec 29, 2024 |
| Radiation | Protocol: SINGLE WAVELENGTH / Monochromatic (M) / Laue (L): M / Scattering type: x-ray |
| Radiation wavelength | Wavelength: 0.97918 Å / Relative weight: 1 |
| Reflection | Resolution: 2.34→45.21 Å / Num. obs: 12400 / % possible obs: 91.2 % / Redundancy: 5.3 % / CC1/2: 0.995 / Net I/σ(I): 15.3 |
| Reflection shell | Resolution: 2.34→2.42 Å / Num. unique obs: 1267 / CC1/2: 0.965 |
- Processing
Processing
| Software |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Refinement | Method to determine structure:  MOLECULAR REPLACEMENT MOLECULAR REPLACEMENTStarting model: 9VEM Resolution: 2.34→45.21 Å / Cor.coef. Fo:Fc: 0.957 / Cor.coef. Fo:Fc free: 0.932 / SU B: 16.698 / SU ML: 0.192 / Cross valid method: FREE R-VALUE / ESU R: 0.508 / ESU R Free: 0.265 Details: Hydrogens have been added in their riding positions
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solvent computation | Ion probe radii: 0.8 Å / Shrinkage radii: 0.8 Å / VDW probe radii: 1.2 Å / Solvent model: MASK BULK SOLVENT | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Displacement parameters | Biso mean: 43.592 Å2
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement step | Cycle: LAST / Resolution: 2.34→45.21 Å
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine LS restraints |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS refinement shell | Refine-ID: X-RAY DIFFRACTION / Total num. of bins used: 20
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS params. | Method: refined / Refine-ID: X-RAY DIFFRACTION
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS group |
|
 Movie
Movie Controller
Controller


 PDBj
PDBj


















