[English] 日本語
 Yorodumi
Yorodumi- PDB-9vem: SIRT2 structure in complex with H3K18myr peptide and native NAD: ... -
+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 9vem | ||||||
|---|---|---|---|---|---|---|---|
| Title | SIRT2 structure in complex with H3K18myr peptide and native NAD: pre-catalysis state 1 | ||||||
 Components Components |
| ||||||
 Keywords Keywords | HYDROLASE / Deacylated / cell cycle regulation / Metabolic regulation | ||||||
| Function / homology |  Function and homology information Function and homology informationcellular response to caloric restriction / negative regulation of oligodendrocyte progenitor proliferation / negative regulation of striated muscle tissue development / negative regulation of satellite cell differentiation / histone H4K16 deacetylase activity, NAD-dependent / positive regulation of attachment of spindle microtubules to kinetochore / positive regulation of meiotic nuclear division / NAD-dependent protein demyristoylase activity / NAD-dependent protein depalmitoylase activity / paranodal junction ...cellular response to caloric restriction / negative regulation of oligodendrocyte progenitor proliferation / negative regulation of striated muscle tissue development / negative regulation of satellite cell differentiation / histone H4K16 deacetylase activity, NAD-dependent / positive regulation of attachment of spindle microtubules to kinetochore / positive regulation of meiotic nuclear division / NAD-dependent protein demyristoylase activity / NAD-dependent protein depalmitoylase activity / paranodal junction / tubulin deacetylation / peptidyl-lysine deacetylation / lateral loop / NLRP3 inflammasome complex assembly / mitotic nuclear membrane reassembly / tubulin deacetylase activity / negative regulation of NLRP3 inflammasome complex assembly / paranode region of axon / regulation of exit from mitosis / Schmidt-Lanterman incisure / negative regulation of peptidyl-threonine phosphorylation / positive regulation of fatty acid biosynthetic process / NAD-dependent protein lysine deacetylase activity / regulation of phosphorylation / protein acetyllysine N-acetyltransferase / myelination in peripheral nervous system / rDNA heterochromatin formation / protein deacetylation / histone deacetylase activity, NAD-dependent / positive regulation of oocyte maturation / juxtaparanode region of axon / Initiation of Nuclear Envelope (NE) Reformation / chromatin silencing complex / meiotic spindle / protein lysine deacetylase activity / histone deacetylase activity / regulation of myelination / response to redox state / positive regulation of DNA binding / histone acetyltransferase binding / negative regulation of fat cell differentiation / negative regulation of reactive oxygen species metabolic process / positive regulation of cell division / NAD+ poly-ADP-ribosyltransferase activity / NAD+ binding / glial cell projection / positive regulation of execution phase of apoptosis / subtelomeric heterochromatin formation / heterochromatin / lipid catabolic process / Chromatin modifying enzymes / Transferases; Acyltransferases; Transferring groups other than aminoacyl groups / centriole / cellular response to epinephrine stimulus / substantia nigra development / negative regulation of autophagy / telomere organization / Interleukin-7 signaling / RNA Polymerase I Promoter Opening / epigenetic regulation of gene expression / Assembly of the ORC complex at the origin of replication / Regulation of endogenous retroelements by the Human Silencing Hub (HUSH) complex / ubiquitin binding / DNA methylation / Condensation of Prophase Chromosomes / Chromatin modifications during the maternal to zygotic transition (MZT) / SIRT1 negatively regulates rRNA expression / HCMV Late Events / ERCC6 (CSB) and EHMT2 (G9a) positively regulate rRNA expression / PRC2 methylates histones and DNA / Regulation of endogenous retroelements by KRAB-ZFP proteins / Defective pyroptosis / meiotic cell cycle / HDACs deacetylate histones / Regulation of endogenous retroelements by Piwi-interacting RNAs (piRNAs) / RNA Polymerase I Promoter Escape / Transcriptional regulation by small RNAs / Formation of the beta-catenin:TCF transactivating complex / Activated PKN1 stimulates transcription of AR (androgen receptor) regulated genes KLK2 and KLK3 / RUNX1 regulates genes involved in megakaryocyte differentiation and platelet function / HDMs demethylate histones / negative regulation of protein catabolic process / NoRC negatively regulates rRNA expression / B-WICH complex positively regulates rRNA expression / PKMTs methylate histone lysines / autophagy / Pre-NOTCH Transcription and Translation / Meiotic recombination / histone deacetylase binding / Activation of anterior HOX genes in hindbrain development during early embryogenesis / spindle / RMTs methylate histone arginines / Transcriptional regulation of granulopoiesis / HCMV Early Events / mitotic spindle / structural constituent of chromatin / heterochromatin formation / nucleosome / positive regulation of proteasomal ubiquitin-dependent protein catabolic process / myelin sheath Similarity search - Function | ||||||
| Biological species |  Homo sapiens (human) Homo sapiens (human) | ||||||
| Method |  X-RAY DIFFRACTION / X-RAY DIFFRACTION /  SYNCHROTRON / SYNCHROTRON /  MOLECULAR REPLACEMENT / Resolution: 2.57 Å MOLECULAR REPLACEMENT / Resolution: 2.57 Å | ||||||
 Authors Authors | Zhang, N. / Hao, Q. | ||||||
| Funding support |  China, 1items China, 1items
| ||||||
 Citation Citation |  Journal: Rsc Chem Biol / Year: 2025 Journal: Rsc Chem Biol / Year: 2025Title: Structural basis of SIRT2 pre-catalysis NAD + binding dynamics and mechanism. Authors: Zhang, N. / Pow, K.C. / Chen, L. / Hao, Q. | ||||||
| History |
|
- Structure visualization
Structure visualization
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  9vem.cif.gz 9vem.cif.gz | 164.9 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb9vem.ent.gz pdb9vem.ent.gz | 105.4 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  9vem.json.gz 9vem.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Summary document |  9vem_validation.pdf.gz 9vem_validation.pdf.gz | 944.7 KB | Display |  wwPDB validaton report wwPDB validaton report |
|---|---|---|---|---|
| Full document |  9vem_full_validation.pdf.gz 9vem_full_validation.pdf.gz | 947.9 KB | Display | |
| Data in XML |  9vem_validation.xml.gz 9vem_validation.xml.gz | 16.2 KB | Display | |
| Data in CIF |  9vem_validation.cif.gz 9vem_validation.cif.gz | 21.2 KB | Display | |
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/ve/9vem https://data.pdbj.org/pub/pdb/validation_reports/ve/9vem ftp://data.pdbj.org/pub/pdb/validation_reports/ve/9vem ftp://data.pdbj.org/pub/pdb/validation_reports/ve/9vem | HTTPS FTP |
-Related structure data
| Related structure data |  9v7wC  9vewC  9vg0C  9vg3C  9vgeC  9vgzC  9vh0C  4x3oS S: Starting model for refinement C: citing same article ( |
|---|---|
| Similar structure data | Similarity search - Function & homology  F&H Search F&H Search |
- Links
Links
- Assembly
Assembly
| Deposited unit | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| Unit cell |
|
- Components
Components
-Protein / Protein/peptide , 2 types, 2 molecules AC
| #1: Protein | Mass: 34404.691 Da / Num. of mol.: 1 Source method: isolated from a genetically manipulated source Source: (gene. exp.)  Homo sapiens (human) / Gene: SIRT2, SIR2L, SIR2L2 / Production host: Homo sapiens (human) / Gene: SIRT2, SIR2L, SIR2L2 / Production host:  References: UniProt: Q8IXJ6, protein acetyllysine N-acetyltransferase, Transferases; Acyltransferases; Transferring groups other than aminoacyl groups |
|---|---|
| #2: Protein/peptide | Mass: 713.868 Da / Num. of mol.: 1 / Source method: obtained synthetically / Source: (synth.)  Homo sapiens (human) / References: UniProt: P68431 Homo sapiens (human) / References: UniProt: P68431 |
-Non-polymers , 7 types, 45 molecules 




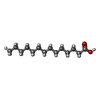







| #3: Chemical | ChemComp-NAD / | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| #4: Chemical | | #5: Chemical | ChemComp-EDO / #6: Chemical | ChemComp-GOL / | #7: Chemical | ChemComp-ZN / | #8: Chemical | ChemComp-MYR / | #9: Water | ChemComp-HOH / | |
-Details
| Has ligand of interest | Y |
|---|---|
| Has protein modification | Y |
-Experimental details
-Experiment
| Experiment | Method:  X-RAY DIFFRACTION / Number of used crystals: 1 X-RAY DIFFRACTION / Number of used crystals: 1 |
|---|
- Sample preparation
Sample preparation
| Crystal | Density Matthews: 2.36 Å3/Da / Density % sol: 47.97 % |
|---|---|
| Crystal grow | Temperature: 289 K / Method: vapor diffusion, sitting drop / Details: Tris 8.0, 25% PEG 2000MME |
-Data collection
| Diffraction | Mean temperature: 100 K / Serial crystal experiment: N |
|---|---|
| Diffraction source | Source:  SYNCHROTRON / Site: SYNCHROTRON / Site:  SSRF SSRF  / Beamline: BL19U1 / Wavelength: 0.97861 Å / Beamline: BL19U1 / Wavelength: 0.97861 Å |
| Detector | Type: DECTRIS PILATUS 6M / Detector: PIXEL / Date: Apr 4, 2025 |
| Radiation | Protocol: SINGLE WAVELENGTH / Monochromatic (M) / Laue (L): M / Scattering type: x-ray |
| Radiation wavelength | Wavelength: 0.97861 Å / Relative weight: 1 |
| Reflection | Resolution: 2.57→55.251 Å / Num. obs: 10021 / % possible obs: 99.2 % / Redundancy: 6.9 % / CC1/2: 0.991 / Net I/σ(I): 7.1 |
| Reflection shell | Resolution: 2.57→2.68 Å / Num. unique obs: 1234 / CC1/2: 0.767 |
- Processing
Processing
| Software |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Refinement | Method to determine structure:  MOLECULAR REPLACEMENT MOLECULAR REPLACEMENTStarting model: 4X3O Resolution: 2.57→55.251 Å / Cor.coef. Fo:Fc: 0.945 / Cor.coef. Fo:Fc free: 0.883 / SU B: 25.946 / SU ML: 0.272 / Cross valid method: FREE R-VALUE / ESU R Free: 0.352 Details: Hydrogens have been added in their riding positions
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solvent computation | Ion probe radii: 0.8 Å / Shrinkage radii: 0.8 Å / VDW probe radii: 1.2 Å / Solvent model: MASK BULK SOLVENT | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Displacement parameters | Biso mean: 46.722 Å2
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement step | Cycle: LAST / Resolution: 2.57→55.251 Å
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine LS restraints |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS refinement shell | Refine-ID: X-RAY DIFFRACTION / Total num. of bins used: 20
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS params. | Method: refined / Refine-ID: X-RAY DIFFRACTION
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS group |
|
 Movie
Movie Controller
Controller


 PDBj
PDBj



















