+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 9qr1 | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
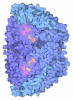
| タイトル | Methyl-coenzyme M reductase of ANME-2d Candidatus Methanoperedens sp. BLZ2 from a bioreactor enrichment culture | ||||||||||||||||||
 要素 要素 |
| ||||||||||||||||||
 キーワード キーワード | TRANSFERASE / methanotrophy / anaerobic methanotrophic archaea / methane oxidation / ANME / methyl-coenzyme M reductase / MCR / reverse methanogenesis / nickel-dependent enzyme / coenzyme M / coenzyme B / F430 cofactor | ||||||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報coenzyme-B sulfoethylthiotransferase / coenzyme-B sulfoethylthiotransferase activity / methanogenesis / metal ion binding 類似検索 - 分子機能 | ||||||||||||||||||
| 生物種 |  Candidatus Methanoperedens sp. BLZ2 (古細菌) Candidatus Methanoperedens sp. BLZ2 (古細菌) | ||||||||||||||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 0.98 Å 分子置換 / 解像度: 0.98 Å | ||||||||||||||||||
 データ登録者 データ登録者 | Mueller, M.-C. / Wagner, T. | ||||||||||||||||||
| 資金援助 | European Union,  ドイツ, ドイツ,  オランダ, 5件 オランダ, 5件
| ||||||||||||||||||
 引用 引用 |  ジャーナル: To Be Published ジャーナル: To Be Publishedタイトル: Atomic resolution structures of the key enzyme MCR in anaerobic methanotrophy reveal novel and extensive post-translational modifications. 著者: Mueller, M.-C. / Wissink, M. / Mukherjee, P. / von Possel, N. / Laso-Perez, R. / Engilberge, S. / Carpentier, P. / Kahnt, J. / Wegener, G. / Welte, C.U. / Wagner, T. | ||||||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  9qr1.cif.gz 9qr1.cif.gz | 1.5 MB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb9qr1.ent.gz pdb9qr1.ent.gz | 表示 |  PDB形式 PDB形式 | |
| PDBx/mmJSON形式 |  9qr1.json.gz 9qr1.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  9qr1_validation.pdf.gz 9qr1_validation.pdf.gz | 854.6 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  9qr1_full_validation.pdf.gz 9qr1_full_validation.pdf.gz | 859.8 KB | 表示 | |
| XML形式データ |  9qr1_validation.xml.gz 9qr1_validation.xml.gz | 142.2 KB | 表示 | |
| CIF形式データ |  9qr1_validation.cif.gz 9qr1_validation.cif.gz | 203.4 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/qr/9qr1 https://data.pdbj.org/pub/pdb/validation_reports/qr/9qr1 ftp://data.pdbj.org/pub/pdb/validation_reports/qr/9qr1 ftp://data.pdbj.org/pub/pdb/validation_reports/qr/9qr1 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  9qr3C C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| 単位格子 |
|
- 要素
要素
-Methyl-coenzyme M reductase subunit ... , 2種, 4分子 ADBE
| #1: タンパク質 | 分子量: 61535.535 Da / 分子数: 2 / 由来タイプ: 天然 詳細: The alpha subunit contains six post-translational modifications: Methylhistidine 268 Methylarginine 282 Hydroxytryptophane 439 Thioglycine 457 Didehydroaspartate 462 Methylcysteine 464 由来: (天然)  Candidatus Methanoperedens sp. BLZ2 (古細菌) Candidatus Methanoperedens sp. BLZ2 (古細菌)細胞株: / / 器官: / / Plasmid details: / / Variant: / / 株: BLZ2 / 組織: / 参照: UniProt: A0A6A2FLY3, coenzyme-B sulfoethylthiotransferase #2: タンパク質 | 分子量: 45366.742 Da / 分子数: 2 / 由来タイプ: 天然 由来: (天然)  Candidatus Methanoperedens sp. BLZ2 (古細菌) Candidatus Methanoperedens sp. BLZ2 (古細菌)細胞株: / / 器官: / / Plasmid details: / / Variant: / / 株: BLZ2 / 組織: / 参照: UniProt: A0A6A2G3Q8, coenzyme-B sulfoethylthiotransferase |
|---|
-タンパク質 , 1種, 2分子 CF
| #3: タンパク質 | 分子量: 28197.822 Da / 分子数: 2 / 由来タイプ: 天然 詳細: The gamma subunit contains a methylhistidine at position 159. 由来: (天然)  Candidatus Methanoperedens sp. BLZ2 (古細菌) Candidatus Methanoperedens sp. BLZ2 (古細菌)細胞株: / / 器官: / / Plasmid details: / / Variant: / / 株: BLZ2 / 組織: / 参照: UniProt: A0A5E4HJB0, coenzyme-B sulfoethylthiotransferase |
|---|
-非ポリマー , 8種, 3454分子 


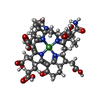









| #4: 化合物 | ChemComp-NA / | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| #5: 化合物 | ChemComp-EDO / #6: 化合物 | ChemComp-NO3 / #7: 化合物 | #8: 化合物 | #9: 化合物 | #10: 化合物 | #11: 水 | ChemComp-HOH / | |
-詳細
| 研究の焦点であるリガンドがあるか | Y |
|---|---|
| Has protein modification | Y |
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.2 Å3/Da / 溶媒含有率: 44 % / 解説: Thick, yellow, brick-shaped |
|---|---|
| 結晶化 | 温度: 291.15 K / 手法: 蒸気拡散法, シッティングドロップ法 / pH: 8 詳細: Crystallisation was carried out on a junior Clover plate using a solution containing 20% w/v polyethylene glycol 3,350, 50 mM Tris pH 8.0, and 200 mM potassium nitrate. The reservoir ...詳細: Crystallisation was carried out on a junior Clover plate using a solution containing 20% w/v polyethylene glycol 3,350, 50 mM Tris pH 8.0, and 200 mM potassium nitrate. The reservoir contained 100 ul of crystallisation solution. 5 ul protein at 2.19 mg/ml in 25 mM Tris/HCl pH 8.0, 100 mM NaCl, 10% v/v glycerol and 2 mM dithiothreitol were mixed with 2 ul of the crystallisation solution. Crystals were soaked in a crystallisation solution supplemented with 20% ethylene glycol before freezing in liquid nitrogen. |
-データ収集
| 回折 | 平均測定温度: 100 K / Serial crystal experiment: N |
|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  ESRF ESRF  / ビームライン: BM07 / 波長: 0.9798 Å / ビームライン: BM07 / 波長: 0.9798 Å |
| 検出器 | タイプ: DECTRIS PILATUS 6M / 検出器: PIXEL / 日付: 2023年3月30日 |
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長: 0.9798 Å / 相対比: 1 |
| 反射 | 解像度: 0.976→76.674 Å / Num. obs: 1130261 / % possible obs: 96.5 % / 冗長度: 7.8 % / CC1/2: 0.996 / Rmerge(I) obs: 0.119 / Rpim(I) all: 0.045 / Rrim(I) all: 0.128 / Net I/σ(I): 9.4 |
| 反射 シェル | 解像度: 0.976→1.04 Å / 冗長度: 7.1 % / Rmerge(I) obs: 1.168 / Mean I/σ(I) obs: 1.7 / Num. unique obs: 56513 / CC1/2: 0.667 / Rpim(I) all: 0.468 / Rrim(I) all: 1.26 / % possible all: 70.9 |
- 解析
解析
| ソフトウェア |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  分子置換 / 解像度: 0.98→41.78 Å / SU ML: 0.06 / 交差検証法: FREE R-VALUE / σ(F): 1.34 / 位相誤差: 10.72 / 立体化学のターゲット値: ML 分子置換 / 解像度: 0.98→41.78 Å / SU ML: 0.06 / 交差検証法: FREE R-VALUE / σ(F): 1.34 / 位相誤差: 10.72 / 立体化学のターゲット値: ML詳細: The model was built and corrected with COOT (Version 0.8.9.2)(52) and refined with PHENIX.refine. All atoms were considered anisotropic, with hydrogens added in riding mode. The model was ...詳細: The model was built and corrected with COOT (Version 0.8.9.2)(52) and refined with PHENIX.refine. All atoms were considered anisotropic, with hydrogens added in riding mode. The model was validated by the MolProbity server (http://molprobity.biochem.duke.edu).
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | 減衰半径: 0.9 Å / VDWプローブ半径: 1.1 Å / 溶媒モデル: FLAT BULK SOLVENT MODEL | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 10.72 Å2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 0.98→41.78 Å
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル |
|
 ムービー
ムービー コントローラー
コントローラー



 PDBj
PDBj