[English] 日本語
 Yorodumi
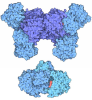
Yorodumi- PDB-9qgg: Consensus structure of dUBA1-UbDha-dBIRC6 trapped ternary complex -
+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 9qgg | |||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Title | Consensus structure of dUBA1-UbDha-dBIRC6 trapped ternary complex | |||||||||||||||||||||||||||
 Components Components |
| |||||||||||||||||||||||||||
 Keywords Keywords | LIGASE / Ubiquitin / E1 / E2 / SIGNALING PROTEIN | |||||||||||||||||||||||||||
| Function / homology |  Function and homology information Function and homology informationnegative regulation of nurse cell apoptotic process / larval midgut cell programmed cell death / Synthesis of active ubiquitin: roles of E1 and E2 enzymes / : / Antigen processing: Ubiquitination & Proteasome degradation / mushroom body development / follicle cell of egg chamber development / regulation of Ras protein signal transduction / E1 ubiquitin-activating enzyme / regulation of programmed cell death ...negative regulation of nurse cell apoptotic process / larval midgut cell programmed cell death / Synthesis of active ubiquitin: roles of E1 and E2 enzymes / : / Antigen processing: Ubiquitination & Proteasome degradation / mushroom body development / follicle cell of egg chamber development / regulation of Ras protein signal transduction / E1 ubiquitin-activating enzyme / regulation of programmed cell death / ubiquitin activating enzyme activity / peptidase inhibitor activity / lipid storage / programmed cell death / regulation of growth / oogenesis / negative regulation of macroautophagy / neuron remodeling / ubiquitin conjugating enzyme activity / spermatid development / negative regulation of hippo signaling / mitophagy / Maturation of protein E / Maturation of protein E / ER Quality Control Compartment (ERQC) / Myoclonic epilepsy of Lafora / FLT3 signaling by CBL mutants / Constitutive Signaling by NOTCH1 HD Domain Mutants / IRAK2 mediated activation of TAK1 complex / Prevention of phagosomal-lysosomal fusion / Alpha-protein kinase 1 signaling pathway / Glycogen synthesis / IRAK1 recruits IKK complex / IRAK1 recruits IKK complex upon TLR7/8 or 9 stimulation / Endosomal Sorting Complex Required For Transport (ESCRT) / Membrane binding and targetting of GAG proteins / Negative regulation of FLT3 / Regulation of TBK1, IKKε (IKBKE)-mediated activation of IRF3, IRF7 / PTK6 Regulates RTKs and Their Effectors AKT1 and DOK1 / Regulation of TBK1, IKKε-mediated activation of IRF3, IRF7 upon TLR3 ligation / IRAK2 mediated activation of TAK1 complex upon TLR7/8 or 9 stimulation / NOTCH2 Activation and Transmission of Signal to the Nucleus / TICAM1,TRAF6-dependent induction of TAK1 complex / TICAM1-dependent activation of IRF3/IRF7 / APC/C:Cdc20 mediated degradation of Cyclin B / Regulation of FZD by ubiquitination / Downregulation of ERBB4 signaling / APC-Cdc20 mediated degradation of Nek2A / p75NTR recruits signalling complexes / InlA-mediated entry of Listeria monocytogenes into host cells / TRAF6 mediated IRF7 activation in TLR7/8 or 9 signaling / TRAF6-mediated induction of TAK1 complex within TLR4 complex / Regulation of pyruvate metabolism / NF-kB is activated and signals survival / Regulation of innate immune responses to cytosolic DNA / Pexophagy / Downregulation of ERBB2:ERBB3 signaling / NRIF signals cell death from the nucleus / Activated NOTCH1 Transmits Signal to the Nucleus / Regulation of PTEN localization / VLDLR internalisation and degradation / cellular response to starvation / Regulation of BACH1 activity / Synthesis of active ubiquitin: roles of E1 and E2 enzymes / MAP3K8 (TPL2)-dependent MAPK1/3 activation / Translesion synthesis by REV1 / TICAM1, RIP1-mediated IKK complex recruitment / Translesion synthesis by POLK / InlB-mediated entry of Listeria monocytogenes into host cell / Activation of IRF3, IRF7 mediated by TBK1, IKKε (IKBKE) / JNK (c-Jun kinases) phosphorylation and activation mediated by activated human TAK1 / Josephin domain DUBs / Downregulation of TGF-beta receptor signaling / Translesion synthesis by POLI / Gap-filling DNA repair synthesis and ligation in GG-NER / IKK complex recruitment mediated by RIP1 / Regulation of activated PAK-2p34 by proteasome mediated degradation / regulation of cytokinesis / PINK1-PRKN Mediated Mitophagy / TGF-beta receptor signaling in EMT (epithelial to mesenchymal transition) / TNFR1-induced NF-kappa-B signaling pathway / Autodegradation of Cdh1 by Cdh1:APC/C / TCF dependent signaling in response to WNT / APC/C:Cdc20 mediated degradation of Securin / Regulation of NF-kappa B signaling / N-glycan trimming in the ER and Calnexin/Calreticulin cycle / activated TAK1 mediates p38 MAPK activation / Asymmetric localization of PCP proteins / SCF-beta-TrCP mediated degradation of Emi1 / NIK-->noncanonical NF-kB signaling / Ubiquitin-dependent degradation of Cyclin D / macroautophagy / TNFR2 non-canonical NF-kB pathway / Regulation of signaling by CBL / AUF1 (hnRNP D0) binds and destabilizes mRNA / NOTCH3 Activation and Transmission of Signal to the Nucleus / Negative regulators of DDX58/IFIH1 signaling / Vpu mediated degradation of CD4 / Assembly of the pre-replicative complex / Ubiquitin-Mediated Degradation of Phosphorylated Cdc25A Similarity search - Function | |||||||||||||||||||||||||||
| Biological species |   Homo sapiens (human) Homo sapiens (human) | |||||||||||||||||||||||||||
| Method | ELECTRON MICROSCOPY / single particle reconstruction / cryo EM / Resolution: 2.58 Å | |||||||||||||||||||||||||||
 Authors Authors | Riechmann, C. / Elliott, P.R. | |||||||||||||||||||||||||||
| Funding support |  United Kingdom, 2items United Kingdom, 2items
| |||||||||||||||||||||||||||
 Citation Citation |  Journal: Nat Struct Mol Biol / Year: 2025 Journal: Nat Struct Mol Biol / Year: 2025Title: UBA6 specificity for ubiquitin E2 conjugating enzymes reveals a priority mechanism of BIRC6. Authors: Carlos Riechmann / Cara J Ellison / Jake W Anderson / Kay Hofmann / Peter Sarkies / Paul R Elliott /   Abstract: In mammals, ubiquitylation is orchestrated by the canonical ubiquitin-activating E1 enzyme UBA1 and the orthogonal E1 UBA6. Growing evidence underscores the essentiality of both E1s, which ...In mammals, ubiquitylation is orchestrated by the canonical ubiquitin-activating E1 enzyme UBA1 and the orthogonal E1 UBA6. Growing evidence underscores the essentiality of both E1s, which differentiate between 29 active ubiquitin-conjugating enzymes (E2s). The mechanisms governing this distinction have remained unclear. Here we establish a framework for ubiquitin E1-E2 specificity. Focusing on UBA6-controlled ubiquitylation cascades, we reveal that BIRC6, a UBA6-exclusive E2, gains priority over all other UBA6-competent E2s, underpinning the functional importance of defined UBA6-BIRC6 ubiquitylation events in regulating cell death, embryogenesis and autophagy. By capturing BIRC6 receiving ubiquitin from UBA6 in different states, we observe BIRC6 engaging with the UBA6 ubiquitin fold domain, driving an exceptionally high-affinity interaction that is modulated by the UBA6 Cys-Cap loop. Using this interaction as a template, we demonstrate how to confer activity between E2s and their noncognate E1, providing a tool to delineate E1-E2-dependent pathways. Lastly, we explain how BIRC6 priority does not lead to inhibition of UBA6, through a bespoke thioester switch mechanism that disengages BIRC6 upon receiving ubiquitin. Our findings propose a concept of hierarchy of E2 activity with cognate E1s, which may explain how ubiquitin E1s can each function with over a dozen E2s and orchestrate E2-specific cellular functions. | |||||||||||||||||||||||||||
| History |
|
- Structure visualization
Structure visualization
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  9qgg.cif.gz 9qgg.cif.gz | 283.2 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb9qgg.ent.gz pdb9qgg.ent.gz | 219.3 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  9qgg.json.gz 9qgg.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/qg/9qgg https://data.pdbj.org/pub/pdb/validation_reports/qg/9qgg ftp://data.pdbj.org/pub/pdb/validation_reports/qg/9qgg ftp://data.pdbj.org/pub/pdb/validation_reports/qg/9qgg | HTTPS FTP |
|---|
-Related structure data
| Related structure data |  53130MC  9qgiC  9qgrC  9qgwC  9qh5C  9qhiC  9qiaC  9qicC  9qigC  9qiiC  9qimC  9qioC  9qipC  9qivC M: map data used to model this data C: citing same article ( |
|---|---|
| Similar structure data | Similarity search - Function & homology  F&H Search F&H Search |
- Links
Links
- Assembly
Assembly
| Deposited unit | 
|
|---|---|
| 1 |
|
- Components
Components
| #1: Protein | Mass: 35565.340 Da / Num. of mol.: 1 Source method: isolated from a genetically manipulated source Source: (gene. exp.)  Gene: Bruce, BRUCE, bruce, dBRUCE, dBruce, dbruce, Dmel\CG6303, mod86, CG6303, Dmel_CG6303 Production host:  References: UniProt: A0A0B4KG50, E2 ubiquitin-conjugating enzyme | ||||||
|---|---|---|---|---|---|---|---|
| #2: Protein | Mass: 112045.164 Da / Num. of mol.: 1 Source method: isolated from a genetically manipulated source Source: (gene. exp.)  Gene: Uba1, 2/31, Dmel\CG1782, DmUba1, E1, FBtr0088499, l(2)03405, l(2)05642, l(2)s3484, Uba, Uba 1, UBA-1, uba-1, UBA1, uba1, CG1782, Dmel_CG1782 Production host:  | ||||||
| #3: Protein | Mass: 8590.856 Da / Num. of mol.: 2 Source method: isolated from a genetically manipulated source Source: (gene. exp.)  Homo sapiens (human) / Gene: UBC / Production host: Homo sapiens (human) / Gene: UBC / Production host:  #4: Chemical | ChemComp-AMP / | Has ligand of interest | N | Has protein modification | Y | |
-Experimental details
-Experiment
| Experiment | Method: ELECTRON MICROSCOPY |
|---|---|
| EM experiment | Aggregation state: PARTICLE / 3D reconstruction method: single particle reconstruction |
- Sample preparation
Sample preparation
| Component | Name: Trapped ternary complex with dUBA1 and dBIRC6 transferring ubiquitin Type: COMPLEX / Entity ID: #1-#3 / Source: RECOMBINANT |
|---|---|
| Molecular weight | Value: 0.18 MDa / Experimental value: NO |
| Source (natural) | Organism:  |
| Source (recombinant) | Organism:  |
| Buffer solution | pH: 7.5 |
| Specimen | Embedding applied: NO / Shadowing applied: NO / Staining applied: NO / Vitrification applied: YES |
| Vitrification | Cryogen name: ETHANE |
- Electron microscopy imaging
Electron microscopy imaging
| Experimental equipment |  Model: Titan Krios / Image courtesy: FEI Company |
|---|---|
| Microscopy | Model: TFS KRIOS |
| Electron gun | Electron source:  FIELD EMISSION GUN / Accelerating voltage: 300 kV / Illumination mode: FLOOD BEAM FIELD EMISSION GUN / Accelerating voltage: 300 kV / Illumination mode: FLOOD BEAM |
| Electron lens | Mode: BRIGHT FIELD / Nominal defocus max: 2100 nm / Nominal defocus min: 500 nm |
| Image recording | Electron dose: 36.1 e/Å2 / Film or detector model: GATAN K3 BIOQUANTUM (6k x 4k) |
- Processing
Processing
| CTF correction | Type: PHASE FLIPPING AND AMPLITUDE CORRECTION |
|---|---|
| 3D reconstruction | Resolution: 2.58 Å / Resolution method: FSC 0.143 CUT-OFF / Num. of particles: 333479 / Symmetry type: POINT |
 Movie
Movie Controller
Controller















 PDBj
PDBj