+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 9or7 | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
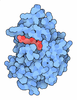
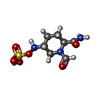
| タイトル | X-ray diffraction structure of CTX-M-14 beta-lactamase soaked with avibactam | ||||||||||||
 要素 要素 | Beta-lactamase | ||||||||||||
 キーワード キーワード | HYDROLASE / enzyme / beta-lactamase / inhibitor / complex | ||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報beta-lactam antibiotic catabolic process / beta-lactamase activity / beta-lactamase / response to antibiotic / metal ion binding 類似検索 - 分子機能 | ||||||||||||
| 生物種 |  | ||||||||||||
| 手法 |  X線回折 / X線回折 /  分子置換 / 解像度: 1.5 Å 分子置換 / 解像度: 1.5 Å | ||||||||||||
 データ登録者 データ登録者 | Vlahakis, N.W. / Rodriguez, J.A. / Jacobs, L.M.C. / Chen, Y. | ||||||||||||
| 資金援助 |  米国, 3件 米国, 3件
| ||||||||||||
 引用 引用 |  ジャーナル: Proc Natl Acad Sci U S A / 年: 2025 ジャーナル: Proc Natl Acad Sci U S A / 年: 2025タイトル: Combining MicroED and native mass spectrometry for structural discovery of enzyme-small molecule complexes. 著者: Niko W Vlahakis / Cameron W Flowers / Mengting Liu / Matthew P Agdanowski / Samuel Johnson / Jacob A Summers / Lian M C Jacobs / Catherine Keyser / Phoebe Russell / Samuel L Rose / Julien ...著者: Niko W Vlahakis / Cameron W Flowers / Mengting Liu / Matthew P Agdanowski / Samuel Johnson / Jacob A Summers / Lian M C Jacobs / Catherine Keyser / Phoebe Russell / Samuel L Rose / Julien Orlans / Nima Adhami / Yu Chen / Michael R Sawaya / Shibom Basu / Daniele de Sanctis / Yu Chen / Soichi Wakatsuki / Hosea M Nelson / Joseph A Loo / Yi Tang / Jose A Rodriguez /   要旨: With the goal of accelerating the discovery of small molecule-protein complexes, we leverage fast, low-dose, event-based electron counting microcrystal electron diffraction (MicroED) data collection ...With the goal of accelerating the discovery of small molecule-protein complexes, we leverage fast, low-dose, event-based electron counting microcrystal electron diffraction (MicroED) data collection and native mass spectrometry. This approach, which we term electron diffraction with native mass spectrometry (ED-MS), allows assignment of protein target structures bound to ligands with data obtained from crystal slurries soaked with mixtures of known inhibitors and crude biosynthetic reactions. This extends to libraries of printed ligands dispensed directly onto TEM grids for later soaking with microcrystal slurries, and complexes with noncovalent ligands. ED-MS resolves structures of the natural product, epoxide-based cysteine protease inhibitor E-64, and its biosynthetic analogs bound to the model cysteine protease, papain. It further identifies papain binding to its preferred natural products, by showing that two analogs of E-64 outcompete others in binding to papain crystals, and by detecting papain bound to E-64 and an analog from crude biosynthetic reactions, without purification. ED-MS also resolves binding of the CTX-M-14 β-lactamase, a target of active drug development, to the non-β-lactam inhibitor, avibactam, alone or in a cocktail of unrelated compounds. These results illustrate the utility of ED-MS for natural product ligand discovery and for structure-based screening of small molecule binders to macromolecular targets, promising utility for drug discovery. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  9or7.cif.gz 9or7.cif.gz | 131.3 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb9or7.ent.gz pdb9or7.ent.gz | 98.5 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  9or7.json.gz 9or7.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  9or7_validation.pdf.gz 9or7_validation.pdf.gz | 1 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  9or7_full_validation.pdf.gz 9or7_full_validation.pdf.gz | 1 MB | 表示 | |
| XML形式データ |  9or7_validation.xml.gz 9or7_validation.xml.gz | 31.9 KB | 表示 | |
| CIF形式データ |  9or7_validation.cif.gz 9or7_validation.cif.gz | 46.1 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/or/9or7 https://data.pdbj.org/pub/pdb/validation_reports/or/9or7 ftp://data.pdbj.org/pub/pdb/validation_reports/or/9or7 ftp://data.pdbj.org/pub/pdb/validation_reports/or/9or7 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  9nbpC  9nbqC  9nc1C  9ncaC  9nccC  9oqeC  9or3C  9orbC  9orgC  9orhC  9orlC  9orsC  9orvC  9orwC  9orxC  9oryC  9orzC  9os0C  9os1C  9os8C C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||
| 2 | 
| ||||||||
| 単位格子 |
|
- 要素
要素
| #1: タンパク質 | 分子量: 28000.547 Da / 分子数: 2 / 断片: UNP residues 23-284 / 由来タイプ: 組換発現 / 由来: (組換発現)  遺伝子: blaCTX-M-14, beta-lactamase CTX-M-14, bla, bla CTX-M-14, bla-CTX-M-14a, blaCTX-M, blaCTX-M-14a, blaCTX-M-14b, blaCTX-M-14c, blaCTX-M-27b, blatoho-3, blaUOE-2, CTX-M-14, AM333_26030, AM340_ ...遺伝子: blaCTX-M-14, beta-lactamase CTX-M-14, bla, bla CTX-M-14, bla-CTX-M-14a, blaCTX-M, blaCTX-M-14a, blaCTX-M-14b, blaCTX-M-14c, blaCTX-M-27b, blatoho-3, blaUOE-2, CTX-M-14, AM333_26030, AM340_28340, AM465_01285, AM465_06510, AM465_23360, APT94_14605, BEN53_26220, BJJ90_27545, BK334_27290, BOH76_00730, BON63_16015, BON65_15195, BON66_01305, BON69_22545, BON72_03470, BON75_10525, BON76_14325, BON83_15455, BON86_08515, BON91_02075, BON92_04750, BON94_23850, BON95_01680, BON96_03940, BON98_23175, BXT93_06855, C5N07_28500, CDL37_21060, CR538_26855, DW236_20870, E4K51_21070, EIA08_25160, EIA21_26975, ELT23_05930, ELV24_09995, ELX61_24095, EST51_15935, EST51_18575, EST51_22260, EST51_22365, ETN48_p0088, FNJ69_13810, FTV90_03295, GE096_24920, GE096_25355, GQE36_23945, HGR36_01450, HGR36_27140, HHH24_004455, HHH24_005319, HJI79_003882, HJI79_004995, HK427_004976, HK427_005087, HL152_24835, HL152_25835, HL563_21800, HL563_23665, HLT96_25270, HLT96_28700, HLU13_27785, HLY53_18605, HLY53_26190, HLZ85_26065, HMW26_20895, HMW26_29355, HNC73_28650, HNC75_27190, HNC75_29165, HNC80_26145, HNC80_27675, HNC88_26185, HNC88_27880, HND23_26750, HND23_28285, HNV91_23425, HNV91_24920, HNV94_24095, HNV94_27845, pCT_085, pHK01_011, RCS103_P0010, RCS30_P0082, RCS56_P0085, RCS60_P0031, RCS63_P0006, RCS65_P0008, RCS66_P0053, SAMEA4362930_00013, SAMEA4363083_00099, SAMEA4370290_00046, WP4S18E07_P40650, WP7S17E01_P10270, WP7S18E09_37980 発現宿主:  #2: 化合物 | #3: 化合物 | #4: 水 | ChemComp-HOH / | 研究の焦点であるリガンドがあるか | Y | Has protein modification | Y | |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.04 Å3/Da / 溶媒含有率: 39.58 % |
|---|---|
| 結晶化 | 温度: 293 K / 手法: 蒸気拡散法, ハンギングドロップ法 / pH: 7.9 / 詳細: 1.4 M potassium phosphate pH 7.9 |
-データ収集
| 回折 | 平均測定温度: 100 K / Serial crystal experiment: N |
|---|---|
| 放射光源 | 由来:  回転陽極 / タイプ: RIGAKU FR-E+ / 波長: 1.5418 Å 回転陽極 / タイプ: RIGAKU FR-E+ / 波長: 1.5418 Å |
| 検出器 | タイプ: RIGAKU / 検出器: IMAGE PLATE / 日付: 2025年5月13日 |
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長: 1.5418 Å / 相対比: 1 |
| 反射 | 解像度: 1.5→46.94 Å / Num. obs: 137873 / % possible obs: 97.7 % / 冗長度: 3.51 % / CC1/2: 0.998 / Rmerge(I) obs: 0.042 / Net I/σ(I): 19.84 |
| 反射 シェル | 解像度: 1.5→1.6 Å / 冗長度: 3.44 % / Rmerge(I) obs: 0.233 / Mean I/σ(I) obs: 6.62 / Num. unique obs: 24033 / CC1/2: 0.951 / % possible all: 97 |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  分子置換 / 解像度: 1.5→46.94 Å / SU ML: 0.16 / 交差検証法: FREE R-VALUE / σ(F): 1.4 / 位相誤差: 18.5 / 立体化学のターゲット値: ML 分子置換 / 解像度: 1.5→46.94 Å / SU ML: 0.16 / 交差検証法: FREE R-VALUE / σ(F): 1.4 / 位相誤差: 18.5 / 立体化学のターゲット値: ML
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | 減衰半径: 0.9 Å / VDWプローブ半径: 1.1 Å / 溶媒モデル: FLAT BULK SOLVENT MODEL | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 1.5→46.94 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル |
|
 ムービー
ムービー コントローラー
コントローラー



 PDBj
PDBj