登録情報 データベース : PDB / ID : 9eyvタイトル Human PRMT5 in complex with AZ compound 12 Methylosome protein WDR77 Protein arginine N-methyltransferase 5, N-terminally processed キーワード / / 機能・相同性 分子機能 ドメイン・相同性 構成要素
/ / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / 生物種 Homo sapiens (ヒト)手法 / / / 解像度 : 2.15 Å データ登録者 Debreczeni, J. 資金援助 1件 ジャーナル : J.Med.Chem. / 年 : 2024タイトル : Discovery and In Vivo Efficacy of AZ-PRMT5i-1, a Novel PRMT5 Inhibitor with High MTA Cooperativity.著者: Smith, J.M. / Barlaam, B. / Beattie, D. / Bradshaw, L. / Chan, H.M. / Chiarparin, E. / Collingwood, O. / Cooke, S.L. / Cronin, A. / Cumming, I. / Dean, E. / Debreczeni, J.E. / Del Barco ... 著者 : Smith, J.M. / Barlaam, B. / Beattie, D. / Bradshaw, L. / Chan, H.M. / Chiarparin, E. / Collingwood, O. / Cooke, S.L. / Cronin, A. / Cumming, I. / Dean, E. / Debreczeni, J.E. / Del Barco Barrantes, I. / Diene, C. / Gianni, D. / Guerot, C. / Guo, X. / Guven, S. / Hayhow, T.G. / Hong, T. / Kemmitt, P.D. / Lamont, G.M. / Lamont, S. / Lynch, J.T. / McWilliams, L. / Moore, S. / Raubo, P. / Robb, G.R. / Robinson, J. / Scott, J.S. / Srinivasan, B. / Steward, O. / Stubbs, C.J. / Syson, K. / Tan, L. / Turner, O. / Underwood, E. / Urosevic, J. / Vazquez-Chantada, M. / Whittaker, A.L. / Wilson, D.M. / Winter-Holt, J.J. 履歴 登録 2024年4月9日 登録サイト / 処理サイト 改定 1.0 2024年8月14日 Provider / タイプ 改定 1.1 2024年9月4日 Group / カテゴリ Item / _citation.page_first / _citation.page_last
すべて表示 表示を減らす
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  分子置換 / 解像度: 2.15 Å
分子置換 / 解像度: 2.15 Å  データ登録者
データ登録者 引用
引用 ジャーナル: J.Med.Chem. / 年: 2024
ジャーナル: J.Med.Chem. / 年: 2024 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 9eyv.cif.gz
9eyv.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb9eyv.ent.gz
pdb9eyv.ent.gz PDB形式
PDB形式 9eyv.json.gz
9eyv.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 9eyv_validation.pdf.gz
9eyv_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 9eyv_full_validation.pdf.gz
9eyv_full_validation.pdf.gz 9eyv_validation.xml.gz
9eyv_validation.xml.gz 9eyv_validation.cif.gz
9eyv_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/ey/9eyv
https://data.pdbj.org/pub/pdb/validation_reports/ey/9eyv ftp://data.pdbj.org/pub/pdb/validation_reports/ey/9eyv
ftp://data.pdbj.org/pub/pdb/validation_reports/ey/9eyv


 F&H 検索
F&H 検索 リンク
リンク 集合体
集合体

 要素
要素 Homo sapiens (ヒト) / 遺伝子: PRMT5, HRMT1L5, IBP72, JBP1, SKB1
Homo sapiens (ヒト) / 遺伝子: PRMT5, HRMT1L5, IBP72, JBP1, SKB1
 Homo sapiens (ヒト) / 遺伝子: WDR77, MEP50, WD45, HKMT1069, Nbla10071
Homo sapiens (ヒト) / 遺伝子: WDR77, MEP50, WD45, HKMT1069, Nbla10071
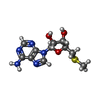




 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  Diamond
Diamond  / ビームライン: I04 / 波長: 0.95373 Å
/ ビームライン: I04 / 波長: 0.95373 Å 解析
解析 分子置換 / 解像度: 2.15→109.318 Å / Cor.coef. Fo:Fc: 0.874 / Cor.coef. Fo:Fc free: 0.835 / SU B: 20.84 / SU ML: 0.257 / 交差検証法: THROUGHOUT / ESU R Free: 0.408 / 立体化学のターゲット値: MAXIMUM LIKELIHOOD / 詳細: HYDROGENS HAVE BEEN ADDED IN THE RIDING POSITIONS
分子置換 / 解像度: 2.15→109.318 Å / Cor.coef. Fo:Fc: 0.874 / Cor.coef. Fo:Fc free: 0.835 / SU B: 20.84 / SU ML: 0.257 / 交差検証法: THROUGHOUT / ESU R Free: 0.408 / 立体化学のターゲット値: MAXIMUM LIKELIHOOD / 詳細: HYDROGENS HAVE BEEN ADDED IN THE RIDING POSITIONS ムービー
ムービー コントローラー
コントローラー



 PDBj
PDBj

