+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 9e3b | ||||||
|---|---|---|---|---|---|---|---|
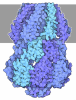
| タイトル | Cryo-EM structure of PRMT5/WDR77 in complex with 6S complex | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード | TRANSFERASE / PRMT5 / Methyl transferase / WDR77 / arginine | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報positive regulation of adenylate cyclase-inhibiting dopamine receptor signaling pathway / peptidyl-arginine N-methylation / oocyte axis specification / type II protein arginine methyltransferase / protein-arginine omega-N symmetric methyltransferase activity / peptidyl-arginine methylation / Golgi ribbon formation / negative regulation of epithelial cell proliferation involved in prostate gland development / secretory columnal luminar epithelial cell differentiation involved in prostate glandular acinus development / histone H4R3 methyltransferase activity ...positive regulation of adenylate cyclase-inhibiting dopamine receptor signaling pathway / peptidyl-arginine N-methylation / oocyte axis specification / type II protein arginine methyltransferase / protein-arginine omega-N symmetric methyltransferase activity / peptidyl-arginine methylation / Golgi ribbon formation / negative regulation of epithelial cell proliferation involved in prostate gland development / secretory columnal luminar epithelial cell differentiation involved in prostate glandular acinus development / histone H4R3 methyltransferase activity / : / epithelial cell proliferation involved in prostate gland development / U12-type spliceosomal complex / 7-methylguanosine cap hypermethylation / U1 snRNP binding / protein-arginine N-methyltransferase activity / methylosome / pICln-Sm protein complex / positive regulation of mRNA splicing, via spliceosome / small nuclear ribonucleoprotein complex / SMN-Sm protein complex / spliceosomal tri-snRNP complex / methyl-CpG binding / U2-type precatalytic spliceosome / commitment complex / mRNA cis splicing, via spliceosome / U2-type spliceosomal complex / cell volume homeostasis / U2-type prespliceosome assembly / U2-type catalytic step 2 spliceosome / chloride transport / U4 snRNP / endothelial cell activation / U2 snRNP / U1 snRNP / histone H3 methyltransferase activity / precatalytic spliceosome / regulation of mitotic nuclear division / histone methyltransferase activity / negative regulation of gene expression via chromosomal CpG island methylation / Cul4B-RING E3 ubiquitin ligase complex / E-box binding / spliceosomal complex assembly / mRNA Splicing - Minor Pathway / histone methyltransferase complex / positive regulation of oligodendrocyte differentiation / negative regulation of cell differentiation / U5 snRNP / spliceosomal snRNP assembly / ribonucleoprotein complex binding / regulation of ERK1 and ERK2 cascade / ubiquitin-like ligase-substrate adaptor activity / U4/U6 x U5 tri-snRNP complex / catalytic step 2 spliceosome / liver regeneration / mRNA Splicing - Major Pathway / RNA splicing / regulation of signal transduction by p53 class mediator / methyltransferase activity / spliceosomal complex / Regulation of TP53 Activity through Methylation / circadian regulation of gene expression / DNA-templated transcription termination / mRNA splicing, via spliceosome / RMTs methylate histone arginines / protein polyubiquitination / p53 binding / transcription corepressor activity / snRNP Assembly / ubiquitin-dependent protein catabolic process / SARS-CoV-2 modulates host translation machinery / cytoskeleton / transcription coactivator activity / cilium / chromatin remodeling / protein heterodimerization activity / intracellular membrane-bounded organelle / positive regulation of cell population proliferation / regulation of transcription by RNA polymerase II / regulation of DNA-templated transcription / chromatin / Golgi apparatus / RNA binding / nucleoplasm / identical protein binding / nucleus / plasma membrane / cytosol / cytoplasm 類似検索 - 分子機能 | ||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.06 Å | ||||||
 データ登録者 データ登録者 | Jin, C.Y. / Hunkeler, M. / Fischer, E.S. | ||||||
| 資金援助 |  米国, 1件 米国, 1件
| ||||||
 引用 引用 |  ジャーナル: J Biol Chem / 年: 2025 ジャーナル: J Biol Chem / 年: 2025タイトル: Substrate adaptors are flexible tethering modules that enhance substrate methylation by the arginine methyltransferase PRMT5. 著者: Cyrus Y Jin / Moritz Hunkeler / Kathleen M Mulvaney / William R Sellers / Eric S Fischer /  要旨: Protein arginine methyltransferase (PRMT) 5 is an essential arginine methyltransferase responsible for the majority of cellular symmetric dimethyl-arginine marks. PRMT5 uses substrate adaptors such ...Protein arginine methyltransferase (PRMT) 5 is an essential arginine methyltransferase responsible for the majority of cellular symmetric dimethyl-arginine marks. PRMT5 uses substrate adaptors such as pICln, RIOK1, and COPR5 to recruit and methylate a wide range of substrates. Although the substrate adaptors play important roles in substrate recognition, how they direct PRMT5 activity towards specific substrates remains incompletely understood. Using biochemistry and cryogenic electron microscopy, we show that these adaptors compete for the same binding site on PRMT5. We find that substrate adaptor and substrate complexes are bound to PRMT5 through two peptide motifs, enabling these adaptors to act as flexible tethering modules to enhance substrate methylation. Taken together, our results shed structural and mechanistic light on the PRMT5 substrate adaptor function and the biochemical nature of PRMT5 interactors. #1: ジャーナル: Acta Crystallogr D Struct Biol / 年: 2019 タイトル: Macromolecular structure determination using X-rays, neutrons and electrons: recent developments in Phenix. 著者: Dorothee Liebschner / Pavel V Afonine / Matthew L Baker / Gábor Bunkóczi / Vincent B Chen / Tristan I Croll / Bradley Hintze / Li Wei Hung / Swati Jain / Airlie J McCoy / Nigel W Moriarty / ...著者: Dorothee Liebschner / Pavel V Afonine / Matthew L Baker / Gábor Bunkóczi / Vincent B Chen / Tristan I Croll / Bradley Hintze / Li Wei Hung / Swati Jain / Airlie J McCoy / Nigel W Moriarty / Robert D Oeffner / Billy K Poon / Michael G Prisant / Randy J Read / Jane S Richardson / David C Richardson / Massimo D Sammito / Oleg V Sobolev / Duncan H Stockwell / Thomas C Terwilliger / Alexandre G Urzhumtsev / Lizbeth L Videau / Christopher J Williams / Paul D Adams /    要旨: Diffraction (X-ray, neutron and electron) and electron cryo-microscopy are powerful methods to determine three-dimensional macromolecular structures, which are required to understand biological ...Diffraction (X-ray, neutron and electron) and electron cryo-microscopy are powerful methods to determine three-dimensional macromolecular structures, which are required to understand biological processes and to develop new therapeutics against diseases. The overall structure-solution workflow is similar for these techniques, but nuances exist because the properties of the reduced experimental data are different. Software tools for structure determination should therefore be tailored for each method. Phenix is a comprehensive software package for macromolecular structure determination that handles data from any of these techniques. Tasks performed with Phenix include data-quality assessment, map improvement, model building, the validation/rebuilding/refinement cycle and deposition. Each tool caters to the type of experimental data. The design of Phenix emphasizes the automation of procedures, where possible, to minimize repetitive and time-consuming manual tasks, while default parameters are chosen to encourage best practice. A graphical user interface provides access to many command-line features of Phenix and streamlines the transition between programs, project tracking and re-running of previous tasks. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  9e3b.cif.gz 9e3b.cif.gz | 1.7 MB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb9e3b.ent.gz pdb9e3b.ent.gz | 1.1 MB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  9e3b.json.gz 9e3b.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  9e3b_validation.pdf.gz 9e3b_validation.pdf.gz | 1.6 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  9e3b_full_validation.pdf.gz 9e3b_full_validation.pdf.gz | 1.6 MB | 表示 | |
| XML形式データ |  9e3b_validation.xml.gz 9e3b_validation.xml.gz | 110.9 KB | 表示 | |
| CIF形式データ |  9e3b_validation.cif.gz 9e3b_validation.cif.gz | 166.5 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/e3/9e3b https://data.pdbj.org/pub/pdb/validation_reports/e3/9e3b ftp://data.pdbj.org/pub/pdb/validation_reports/e3/9e3b ftp://data.pdbj.org/pub/pdb/validation_reports/e3/9e3b | HTTPS FTP |
-関連構造データ
| 関連構造データ |  47477MC  9e3aC  9e3cC C: 同じ文献を引用 ( M: このデータのモデリングに利用したマップデータ |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
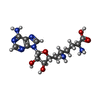
| #1: タンパク質 | 分子量: 72766.664 Da / 分子数: 4 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: PRMT5, HRMT1L5, IBP72, JBP1, SKB1 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: PRMT5, HRMT1L5, IBP72, JBP1, SKB1 / 発現宿主:  Trichoplusia ni (イラクサキンウワバ) / 株 (発現宿主): Hi5 Trichoplusia ni (イラクサキンウワバ) / 株 (発現宿主): Hi5参照: UniProt: O14744, type II protein arginine methyltransferase #2: タンパク質 | 分子量: 37186.695 Da / 分子数: 4 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: WDR77, MEP50, WD45, HKMT1069, Nbla10071 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: WDR77, MEP50, WD45, HKMT1069, Nbla10071 / 発現宿主:  Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: Q9BQA1 Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: Q9BQA1#3: タンパク質 | 分子量: 26552.504 Da / 分子数: 4 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: CLNS1A, CLCI, ICLN / 発現宿主: Homo sapiens (ヒト) / 遺伝子: CLNS1A, CLCI, ICLN / 発現宿主:  #4: タンパク質 | 分子量: 13954.288 Da / 分子数: 4 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: SNRPD1 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: SNRPD1 / 発現宿主:  #5: 化合物 | ChemComp-SFG / 研究の焦点であるリガンドがあるか | Y | Has protein modification | N | 配列の詳細 | The precise residue numbers of the amino acid residues in chains M, N, O, and P (snRNP Sm D1) ...The precise residue numbers of the amino acid residues in chains M, N, O, and P (snRNP Sm D1) cannot be determined because of the number of GR repeats near the C-terminus of the protein. They are numbered such that they end with ARG-114. However, this region could actually be any stretch of GRGRGR between residues 97 and 114 (or in the case of chain N, any stretch of RGRGR between residues 98 and 114). | |
|---|
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 |
| ||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 分子量 | 値: 0.77 MDa / 実験値: NO | ||||||||||||||||||||||||||||||||||||||||||
| 由来(天然) |
| ||||||||||||||||||||||||||||||||||||||||||
| 由来(組換発現) |
| ||||||||||||||||||||||||||||||||||||||||||
| 緩衝液 | pH: 7.4 詳細: 30 mM HEPES pH 7.4, 150 mM NaCl, 3 mM TCEP, 3.33 mM sinefungin | ||||||||||||||||||||||||||||||||||||||||||
| 緩衝液成分 |
| ||||||||||||||||||||||||||||||||||||||||||
| 試料 | 濃度: 1 mg/ml / 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES | ||||||||||||||||||||||||||||||||||||||||||
| 試料支持 | グリッドの材料: COPPER / グリッドのサイズ: 300 divisions/in. / グリッドのタイプ: Quantifoil R1.2/1.3 | ||||||||||||||||||||||||||||||||||||||||||
| 急速凍結 | 装置: LEICA EM GP / 凍結剤: ETHANE / 湿度: 90 % / 凍結前の試料温度: 283 K |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 顕微鏡 | モデル: TFS TALOS |
|---|---|
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 200 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 200 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD / 倍率(公称値): 36000 X / 最大 デフォーカス(公称値): 2200 nm / 最小 デフォーカス(公称値): 800 nm / Cs: 2.7 mm / C2レンズ絞り径: 50 µm / アライメント法: COMA FREE |
| 試料ホルダ | 凍結剤: NITROGEN 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER |
| 撮影 | 平均露光時間: 5 sec. / 電子線照射量: 53.112 e/Å2 / フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 撮影したグリッド数: 1 / 実像数: 3615 |
- 解析
解析
| EMソフトウェア | 名称: PHENIX / バージョン: 1.21.1_5286 / カテゴリ: モデル精密化 | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 画像処理 | 詳細: motioncorrected on the fly by cryosparc live | ||||||||||||||||||||||||
| CTF補正 | 詳細: as implemented in cryosparc live / タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||
| 粒子像の選択 | 選択した粒子像数: 2100293 / 詳細: topaz | ||||||||||||||||||||||||
| 対称性 | 点対称性: C1 (非対称) | ||||||||||||||||||||||||
| 3次元再構成 | 解像度: 3.06 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 377557 / アルゴリズム: FOURIER SPACE / 詳細: as in cryosparc / クラス平均像の数: 1 / 対称性のタイプ: POINT | ||||||||||||||||||||||||
| 原子モデル構築 | B value: 110.5 / プロトコル: OTHER / 空間: REAL / Target criteria: real space correlation | ||||||||||||||||||||||||
| 原子モデル構築 | 3D fitting-ID: 1 / Accession code: 6V0O / Initial refinement model-ID: 1 / PDB-ID: 6V0O / Source name: PDB / タイプ: experimental model
| ||||||||||||||||||||||||
| 精密化 | 交差検証法: NONE 立体化学のターゲット値: GeoStd + Monomer Library + CDL v1.2 | ||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 114.39 Å2 | ||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー





 PDBj
PDBj