+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 9e2s | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | Apo TRiC in closed conformation | ||||||
 要素 要素 | (T-complex protein 1 subunit ...) x 8 | ||||||
 キーワード キーワード | CHAPERONE / human chaperonin | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報zona pellucida receptor complex / positive regulation of establishment of protein localization to telomere / positive regulation of protein localization to Cajal body / scaRNA localization to Cajal body / positive regulation of telomerase RNA localization to Cajal body / tubulin complex assembly / chaperonin-containing T-complex / : / BBSome-mediated cargo-targeting to cilium / Formation of tubulin folding intermediates by CCT/TriC ...zona pellucida receptor complex / positive regulation of establishment of protein localization to telomere / positive regulation of protein localization to Cajal body / scaRNA localization to Cajal body / positive regulation of telomerase RNA localization to Cajal body / tubulin complex assembly / chaperonin-containing T-complex / : / BBSome-mediated cargo-targeting to cilium / Formation of tubulin folding intermediates by CCT/TriC / binding of sperm to zona pellucida / Folding of actin by CCT/TriC / Prefoldin mediated transfer of substrate to CCT/TriC / RHOBTB1 GTPase cycle / WD40-repeat domain binding / pericentriolar material / Association of TriC/CCT with target proteins during biosynthesis / chaperone-mediated protein complex assembly / 加水分解酵素; 酸無水物に作用; リン含有酸無水物に作用 / RHOBTB2 GTPase cycle / beta-tubulin binding / heterochromatin / : / positive regulation of telomere maintenance via telomerase / protein folding chaperone / acrosomal vesicle / Gene and protein expression by JAK-STAT signaling after Interleukin-12 stimulation / mRNA 3'-UTR binding / cell projection / ATP-dependent protein folding chaperone / mRNA 5'-UTR binding / response to virus / azurophil granule lumen / unfolded protein binding / melanosome / Cooperation of PDCL (PhLP1) and TRiC/CCT in G-protein beta folding / protein folding / G-protein beta-subunit binding / cell body / secretory granule lumen / ficolin-1-rich granule lumen / microtubule / cytoskeleton / protein stabilization / cilium / cadherin binding / ubiquitin protein ligase binding / Neutrophil degranulation / centrosome / Golgi apparatus / ATP hydrolysis activity / RNA binding / extracellular exosome / extracellular region / nucleoplasm / ATP binding / identical protein binding / cytosol / cytoplasm 類似検索 - 分子機能 | ||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.7 Å | ||||||
 データ登録者 データ登録者 | Zhao, Y. / Chiu, W. | ||||||
| 資金援助 |  米国, 1件 米国, 1件
| ||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2025 ジャーナル: Nat Commun / 年: 2025タイトル: Visualizing dynamic tubulin folding in chaperonin TRiC from nonnative nucleus to final native state. 著者: Yanyan Zhao / Michael F Schmid / Wah Chiu /  要旨: The folding nucleus (FN) initiates and enables an efficient protein folding pathway. Despite its essential role, the FN has long remained cryptic. Here we directly visualize the tubulin FN consisting ...The folding nucleus (FN) initiates and enables an efficient protein folding pathway. Despite its essential role, the FN has long remained cryptic. Here we directly visualize the tubulin FN consisting of a nonnative, partially assembled Rossmann fold, in the closed chamber of human chaperonin TRiC. Chaperonin TRiC interacts with nonnatively folded secondary structure elements of tubulin, stabilizing the nucleus poised for transition into its first native domain tertiary structure. Through progressive folding into the native state, we observe that the unfolded sequence of tubulin undergoes drastic spatial rearrangement in the TRiC chamber to sample the conformational space, mediated by the highly dynamic CCT tails. The observed presence of individual nonnative secondary structure elements first in the nonnative FN and then around the incrementally folded native domains supports the hypothesis that tubulin folding in TRiC is a hierarchical process of nucleation, condensation and propagation in cooperation with TRiC subunits. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  9e2s.cif.gz 9e2s.cif.gz | 1.8 MB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb9e2s.ent.gz pdb9e2s.ent.gz | 1.2 MB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  9e2s.json.gz 9e2s.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  9e2s_validation.pdf.gz 9e2s_validation.pdf.gz | 2.6 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  9e2s_full_validation.pdf.gz 9e2s_full_validation.pdf.gz | 2.7 MB | 表示 | |
| XML形式データ |  9e2s_validation.xml.gz 9e2s_validation.xml.gz | 201.5 KB | 表示 | |
| CIF形式データ |  9e2s_validation.cif.gz 9e2s_validation.cif.gz | 305.1 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/e2/9e2s https://data.pdbj.org/pub/pdb/validation_reports/e2/9e2s ftp://data.pdbj.org/pub/pdb/validation_reports/e2/9e2s ftp://data.pdbj.org/pub/pdb/validation_reports/e2/9e2s | HTTPS FTP |
-関連構造データ
| 関連構造データ |  47463MC M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
-T-complex protein 1 subunit ... , 8種, 16分子 BbCcDdEeFfGgHhIi
| #1: タンパク質 | 分子量: 59576.332 Da / 分子数: 2 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: CCT8, C21orf112, CCTQ, KIAA0002 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: CCT8, C21orf112, CCTQ, KIAA0002 / 発現宿主:  Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: P50990 Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: P50990#2: タンパク質 | 分子量: 60560.672 Da / 分子数: 2 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: CCT7, CCTH, NIP7-1 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: CCT7, CCTH, NIP7-1 / 発現宿主:  Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: Q99832 Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: Q99832#3: タンパク質 | 分子量: 59749.957 Da / 分子数: 2 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: CCT5, CCTE, KIAA0098 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: CCT5, CCTE, KIAA0098 / 発現宿主:  Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: P48643 Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: P48643#4: タンパク質 | 分子量: 57567.141 Da / 分子数: 2 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: CCT2, 99D8.1, CCTB / 発現宿主: Homo sapiens (ヒト) / 遺伝子: CCT2, 99D8.1, CCTB / 発現宿主:  Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: P78371 Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: P78371#5: タンパク質 | 分子量: 57996.113 Da / 分子数: 2 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: CCT4, CCTD, SRB / 発現宿主: Homo sapiens (ヒト) / 遺伝子: CCT4, CCTD, SRB / 発現宿主:  Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: P50991 Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: P50991#6: タンパク質 | 分子量: 60418.477 Da / 分子数: 2 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: TCP1, CCT1, CCTA / 発現宿主: Homo sapiens (ヒト) / 遺伝子: TCP1, CCT1, CCTA / 発現宿主:  Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: P17987 Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: P17987#7: タンパク質 | 分子量: 60613.855 Da / 分子数: 2 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: CCT3, CCTG, TRIC5 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: CCT3, CCTG, TRIC5 / 発現宿主:  Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: P49368 Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: P49368#8: タンパク質 | 分子量: 58106.086 Da / 分子数: 2 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: CCT6A, CCT6, CCTZ / 発現宿主: Homo sapiens (ヒト) / 遺伝子: CCT6A, CCT6, CCTZ / 発現宿主:  Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: P40227 Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: P40227 |
|---|
-非ポリマー , 4種, 64分子 

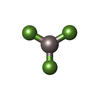




| #9: 化合物 | ChemComp-MG / #10: 化合物 | ChemComp-ADP / #11: 化合物 | ChemComp-AF3 / #12: 水 | ChemComp-HOH / | |
|---|
-詳細
| 研究の焦点であるリガンドがあるか | Y |
|---|---|
| Has protein modification | N |
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: human chaperonin TRiC / タイプ: COMPLEX / Entity ID: #1-#8 / 由来: RECOMBINANT |
|---|---|
| 分子量 | 値: 1 MDa / 実験値: YES |
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 由来(組換発現) | 生物種:  Trichoplusia ni (イラクサキンウワバ) Trichoplusia ni (イラクサキンウワバ) |
| 緩衝液 | pH: 7.2 |
| 試料 | 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES |
| 急速凍結 | 凍結剤: ETHANE |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: TFS KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2500 nm / 最小 デフォーカス(公称値): 1500 nm |
| 撮影 | 電子線照射量: 1.21 e/Å2 フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) |
- 解析
解析
| EMソフトウェア |
| ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||
| 3次元再構成 | 解像度: 3.7 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 40464 / 対称性のタイプ: POINT | ||||||||||||||||||||||||
| 精密化 | 交差検証法: NONE 立体化学のターゲット値: GeoStd + Monomer Library + CDL v1.2 | ||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 75.87 Å2 | ||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー








 PDBj
PDBj















