+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 9c0s | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Carbon monoxide dehydrogenase/acetyl-CoA synthase (CODH/ACS) pentamer from Methanosarcina thermophila | |||||||||
 要素 要素 | (Acetyl-CoA decarbonylase/synthase complex subunit ...) x 3 | |||||||||
 キーワード キーワード | OXIDOREDUCTASE / CO-dehydrogenase / acetyl-CoA synthase / Methanosarcina thermophila | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報methanogenesis, from acetate / CO-methylating acetyl-CoA synthase / CO-methylating acetyl-CoA synthase activity / anaerobic carbon monoxide dehydrogenase / hydroxylamine reductase activity / anaerobic carbon-monoxide dehydrogenase activity / acetyl-CoA metabolic process / acetyltransferase activity / nickel cation binding / iron-sulfur cluster binding ...methanogenesis, from acetate / CO-methylating acetyl-CoA synthase / CO-methylating acetyl-CoA synthase activity / anaerobic carbon monoxide dehydrogenase / hydroxylamine reductase activity / anaerobic carbon-monoxide dehydrogenase activity / acetyl-CoA metabolic process / acetyltransferase activity / nickel cation binding / iron-sulfur cluster binding / peroxidase activity / response to hydrogen peroxide / 4 iron, 4 sulfur cluster binding / iron ion binding 類似検索 - 分子機能 | |||||||||
| 生物種 |   Methanosarcina thermophila (古細菌) Methanosarcina thermophila (古細菌) | |||||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.2 Å | |||||||||
 データ登録者 データ登録者 | Biester, A. / Drennan, C.L. | |||||||||
| 資金援助 |  米国, 2件 米国, 2件
| |||||||||
 引用 引用 |  ジャーナル: Proc Natl Acad Sci U S A / 年: 2024 ジャーナル: Proc Natl Acad Sci U S A / 年: 2024タイトル: Capturing a methanogenic carbon monoxide dehydrogenase/acetyl-CoA synthase complex via cryogenic electron microscopy. 著者: Alison Biester / David A Grahame / Catherine L Drennan /  要旨: Approximately two-thirds of the estimated one-billion metric tons of methane produced annually by methanogens is derived from the cleavage of acetate. Acetate is broken down by a Ni-Fe-S-containing A- ...Approximately two-thirds of the estimated one-billion metric tons of methane produced annually by methanogens is derived from the cleavage of acetate. Acetate is broken down by a Ni-Fe-S-containing A-cluster within the enzyme acetyl-CoA synthase (ACS) to carbon monoxide (CO) and a methyl group (CH). The methyl group ultimately forms the greenhouse gas methane, whereas CO is converted to the greenhouse gas carbon dioxide (CO) by a Ni-Fe-S-containing C-cluster within the enzyme carbon monoxide dehydrogenase (CODH). Although structures have been solved of CODH/ACS from acetogens, which use these enzymes to make acetate from CO, no structure of a CODH/ACS from a methanogen has been reported. In this work, we use cryo-electron microscopy to reveal the structure of a methanogenic CODH and CODH/ACS from (CODH/ACS). We find that the N-terminal domain of acetogenic ACS, which is missing in all methanogens, is replaced by a domain of CODH. This CODH domain provides a channel for CO to travel between the two catalytic Ni-Fe-S clusters. It generates the binding surface for ACS and creates a remarkably similar CO alcove above the A-cluster using residues from CODH rather than ACS. Comparison of our CODH/ACS structure with our CODH structure reveals a molecular mechanism to restrict gas flow from the CO channel when ACS departs, preventing CO escape into the cell. Overall, these long-awaited structures of a methanogenic CODH/ACS reveal striking functional similarities to their acetogenic counterparts despite a substantial difference in domain organization. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  9c0s.cif.gz 9c0s.cif.gz | 436.9 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb9c0s.ent.gz pdb9c0s.ent.gz | 353 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  9c0s.json.gz 9c0s.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  9c0s_validation.pdf.gz 9c0s_validation.pdf.gz | 1.6 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  9c0s_full_validation.pdf.gz 9c0s_full_validation.pdf.gz | 1.7 MB | 表示 | |
| XML形式データ |  9c0s_validation.xml.gz 9c0s_validation.xml.gz | 75.3 KB | 表示 | |
| CIF形式データ |  9c0s_validation.cif.gz 9c0s_validation.cif.gz | 112.7 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/c0/9c0s https://data.pdbj.org/pub/pdb/validation_reports/c0/9c0s ftp://data.pdbj.org/pub/pdb/validation_reports/c0/9c0s ftp://data.pdbj.org/pub/pdb/validation_reports/c0/9c0s | HTTPS FTP |
-関連構造データ
| 関連構造データ |  45091MC  9c0qC  9c0rC  9c0tC C: 同じ文献を引用 ( M: このデータのモデリングに利用したマップデータ |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
| 実験データセット #1 | データ参照:  10.6019/EMPIAR-12124 / データの種類: EMPIAR / Metadata reference: 10.6019/EMPIAR-12124 10.6019/EMPIAR-12124 / データの種類: EMPIAR / Metadata reference: 10.6019/EMPIAR-12124 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
-Acetyl-CoA decarbonylase/synthase complex subunit ... , 3種, 5分子 ABCDE
| #1: タンパク質 | 分子量: 87855.852 Da / 分子数: 2 / 由来タイプ: 天然 / 由来: (天然)   Methanosarcina thermophila (古細菌) Methanosarcina thermophila (古細菌)参照: UniProt: Q9C4Z4, anaerobic carbon monoxide dehydrogenase #2: タンパク質 | 分子量: 18587.375 Da / 分子数: 2 / 由来タイプ: 天然 / 由来: (天然)   Methanosarcina thermophila (古細菌) / 参照: UniProt: Q9C4Z3 Methanosarcina thermophila (古細菌) / 参照: UniProt: Q9C4Z3#3: タンパク質 | | 分子量: 52802.227 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)   Methanosarcina thermophila (古細菌) / 参照: UniProt: Q9V2Z4, CO-methylating acetyl-CoA synthase Methanosarcina thermophila (古細菌) / 参照: UniProt: Q9V2Z4, CO-methylating acetyl-CoA synthase |
|---|
-非ポリマー , 5種, 14分子 


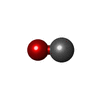





| #4: 化合物 | ChemComp-SF4 / #5: 化合物 | #6: 化合物 | ChemComp-F3S / | #7: 化合物 | ChemComp-CMO / | #8: 化合物 | |
|---|
-詳細
| 研究の焦点であるリガンドがあるか | Y |
|---|---|
| Has protein modification | Y |
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: Acetyl-CoA decarbonylase/synthase complex / タイプ: COMPLEX 詳細: Carbon monoxide dehydrogenase heterotetramer, alpha and epsilon subunits, with acetyl-CoA synthase beta subunit Entity ID: #1-#3 / 由来: NATURAL | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 分子量 | 値: 0.265 MDa / 実験値: NO | |||||||||||||||
| 由来(天然) | 生物種:   Methanosarcina thermophila (古細菌) Methanosarcina thermophila (古細菌) | |||||||||||||||
| 緩衝液 | pH: 7.2 | |||||||||||||||
| 緩衝液成分 |
| |||||||||||||||
| 試料 | 濃度: 1 mg/ml / 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES | |||||||||||||||
| 急速凍結 | 凍結剤: ETHANE / 湿度: 82 % / 凍結前の試料温度: 298 K / 詳細: SPT Labtech chameleon plunger |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD / 倍率(公称値): 130000 X / 最大 デフォーカス(公称値): 1750 nm / 最小 デフォーカス(公称値): 0 nm / Cs: 2.7 mm / C2レンズ絞り径: 50 µm |
| 撮影 | 電子線照射量: 47.1 e/Å2 フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) |
- 解析
解析
| EMソフトウェア |
| ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||
| 粒子像の選択 | 選択した粒子像数: 1124872 | ||||||||||||||||||||||||
| 対称性 | 点対称性: C1 (非対称) | ||||||||||||||||||||||||
| 3次元再構成 | 解像度: 3.2 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 33375 / 対称性のタイプ: POINT | ||||||||||||||||||||||||
| 原子モデル構築 | B value: 76.1221 / 空間: REAL / Target criteria: Correlation coefficient 詳細: Initial model was generated using AlphaFold, fit to the map using ChimeraX, followed by rigid body fitting in phenix, and finally iterative real space refinement in coot and phenix. | ||||||||||||||||||||||||
| 原子モデル構築 | Source name: AlphaFold / タイプ: in silico model | ||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー






 PDBj
PDBj





















