+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 8z8z | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of LYCHOS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 要素 要素 | Lysosomal cholesterol signaling protein,Fluorescent Protein | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 キーワード キーワード | MEMBRANE PROTEIN / Lysosome / GPCR-like / Transporter / Cholesterol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報cellular response to cholesterol / cholesterol binding / negative regulation of BMP signaling pathway / positive regulation of TORC1 signaling / cellular response to amino acid starvation / transmembrane transport / cognition / intracellular signal transduction / lysosomal membrane / extracellular exosome 類似検索 - 分子機能 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト)synthetic construct (人工物) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.11 Å | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 データ登録者 データ登録者 | Xiong, Q. / Zhu, Z. / Li, T. / Zhou, Z. / Chao, Y. / Qu, Q. / Li, D. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 資金援助 |  中国, 1件 中国, 1件
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 引用 引用 |  ジャーナル: Nat Struct Mol Biol / 年: 2025 ジャーナル: Nat Struct Mol Biol / 年: 2025タイトル: Molecular architecture of human LYCHOS involved in lysosomal cholesterol signaling. 著者: Qi Xiong / Zhini Zhu / Tingting Li / Xiaotian Li / Zixuan Zhou / Yulin Chao / Chuanhui Yang / Suihan Feng / Qianhui Qu / Dianfan Li /  要旨: Lysosomal membrane protein LYCHOS (lysosomal cholesterol signaling) translates cholesterol abundance to mammalian target of rapamycin activation. Here we report the 2.11-Å structure of human LYCHOS, ...Lysosomal membrane protein LYCHOS (lysosomal cholesterol signaling) translates cholesterol abundance to mammalian target of rapamycin activation. Here we report the 2.11-Å structure of human LYCHOS, revealing a unique fusion architecture comprising a G-protein-coupled receptor (GPCR)-like domain and a transporter domain that mediates homodimer assembly. The NhaA-fold transporter harbors a previously uncharacterized intramembrane Na pocket. The GPCR-like domain is stabilized, by analogy to canonical GPCRs, in an inactive state through 'tethered antagonism' by a lumenal loop and strong interactions at the cytosol side preventing the hallmark swing of the sixth transmembrane helix seen in active GPCRs. A cholesterol molecule and an associated docosahexaenoic acid (DHA)-phospholipid are entrapped between the transporter and GPCR-like domains, with the DHA-phospholipid occupying a pocket previously implicated in cholesterol sensing, indicating inter-domain coupling via dynamic lipid-protein interactions. Our work provides a high-resolution framework for functional investigations of the understudied LYCHOS protein. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  8z8z.cif.gz 8z8z.cif.gz | 246.4 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb8z8z.ent.gz pdb8z8z.ent.gz | 表示 |  PDB形式 PDB形式 | |
| PDBx/mmJSON形式 |  8z8z.json.gz 8z8z.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  8z8z_validation.pdf.gz 8z8z_validation.pdf.gz | 1.8 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  8z8z_full_validation.pdf.gz 8z8z_full_validation.pdf.gz | 1.9 MB | 表示 | |
| XML形式データ |  8z8z_validation.xml.gz 8z8z_validation.xml.gz | 62.8 KB | 表示 | |
| CIF形式データ |  8z8z_validation.cif.gz 8z8z_validation.cif.gz | 87.8 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/z8/8z8z https://data.pdbj.org/pub/pdb/validation_reports/z8/8z8z ftp://data.pdbj.org/pub/pdb/validation_reports/z8/8z8z ftp://data.pdbj.org/pub/pdb/validation_reports/z8/8z8z | HTTPS FTP |
-関連構造データ
| 関連構造データ |  39851MC M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
-タンパク質 / 糖 , 2種, 4分子 AB

| #1: タンパク質 | 分子量: 127213.109 Da / 分子数: 2 / 由来タイプ: 組換発現 詳細: The protein is a fusion protein with expression tag. Residues 1-3 is the initial methionine and GS linker. Residues 4-873 is LYCHOS (uniport ID Q7Z3F1). Residues 874-889 is the linker with a ...詳細: The protein is a fusion protein with expression tag. Residues 1-3 is the initial methionine and GS linker. Residues 4-873 is LYCHOS (uniport ID Q7Z3F1). Residues 874-889 is the linker with a 3 C protease digestion site. Residues 890-1114 is a thermostable green fluorescent protein fusion (PDB entry 4TZA, residue 5-229). Residues 1115-1144 is the linker with an expression tag 由来: (組換発現)  Homo sapiens (ヒト), (組換発現) synthetic construct (人工物) Homo sapiens (ヒト), (組換発現) synthetic construct (人工物)遺伝子: GPR155, PGR22 / 発現宿主:  Homo sapiens (ヒト) / 参照: UniProt: Q7Z3F1 Homo sapiens (ヒト) / 参照: UniProt: Q7Z3F1#2: 糖 | |
|---|
-非ポリマー , 6種, 16分子 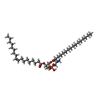








| #3: 化合物 | ChemComp-6OU / [( #4: 化合物 | #5: 化合物 | 分子量: 764.023 Da / 分子数: 2 / 由来タイプ: 合成 / 式: C43H74NO8P / タイプ: SUBJECT OF INVESTIGATION #6: 化合物 | #7: 化合物 | #8: 水 | ChemComp-HOH / | |
|---|
-詳細
| 研究の焦点であるリガンドがあるか | Y |
|---|---|
| Has protein modification | Y |
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: LYCHOS / タイプ: COMPLEX / Entity ID: #1 / 由来: RECOMBINANT | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 分子量 | 値: 0.127 MDa / 実験値: NO | |||||||||||||||||||||||||
| 由来(天然) |
| |||||||||||||||||||||||||
| 由来(組換発現) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||||||||||||||||||
| 緩衝液 | pH: 8 詳細: 0.001 % LMNG, 150 mM NaCl, 0.2 mM TECP, 50 mM Tris HCl pH 8.0 | |||||||||||||||||||||||||
| 緩衝液成分 |
| |||||||||||||||||||||||||
| 試料 | 濃度: 9 mg/ml / 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES | |||||||||||||||||||||||||
| 試料支持 | グリッドの材料: GOLD / グリッドのサイズ: 300 divisions/in. / グリッドのタイプ: Quantifoil R1.2/1.3 | |||||||||||||||||||||||||
| 急速凍結 | 装置: FEI VITROBOT MARK IV / 凍結剤: ETHANE / 湿度: 100 % / 凍結前の試料温度: 277.15 K |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2000 nm / 最小 デフォーカス(公称値): 1500 nm |
| 撮影 | 電子線照射量: 50 e/Å2 フィルム・検出器のモデル: FEI FALCON IV (4k x 4k) |
- 解析
解析
| EMソフトウェア | 名称: PHENIX / カテゴリ: モデル精密化 | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||
| 対称性 | 点対称性: C2 (2回回転対称) | ||||||||||||||||||||||||
| 3次元再構成 | 解像度: 2.11 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 355557 / 対称性のタイプ: POINT | ||||||||||||||||||||||||
| 原子モデル構築 | 空間: REAL | ||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー



 PDBj
PDBj











