[English] 日本語
 Yorodumi
Yorodumi- PDB-8usn: Intracellular cryo-tomography structure of EBOV nucleocapsid at 8... -
+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 8usn | ||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
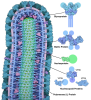
| Title | Intracellular cryo-tomography structure of EBOV nucleocapsid at 8.9 Angstrom | ||||||||||||||||||||||||||||||||||||||||||||||||
 Components Components |
| ||||||||||||||||||||||||||||||||||||||||||||||||
 Keywords Keywords | VIRAL PROTEIN / nucleoprotein / nucleocapsid / Ebola virus / EBOV / filovirus / subtomogram averaging / cryo-ET / FIB / intracellular / in situ | ||||||||||||||||||||||||||||||||||||||||||||||||
| Function / homology |  Function and homology information Function and homology informationhost cell endomembrane system / symbiont-mediated suppression of host defenses / symbiont-mediated suppression of host RNAi-mediated antiviral immune response / negative regulation of miRNA-mediated gene silencing / symbiont-mediated suppression of host cytoplasmic pattern recognition receptor signaling pathway via inhibition of IKBKE activity / symbiont-mediated suppression of host cytoplasmic pattern recognition receptor signaling pathway via inhibition of IRF7 activity / symbiont-mediated suppression of host antigen processing and presentation of peptide antigen via MHC class II / symbiont-mediated suppression of host PKR/eIFalpha signaling / positive regulation of protein sumoylation / viral RNA genome packaging ...host cell endomembrane system / symbiont-mediated suppression of host defenses / symbiont-mediated suppression of host RNAi-mediated antiviral immune response / negative regulation of miRNA-mediated gene silencing / symbiont-mediated suppression of host cytoplasmic pattern recognition receptor signaling pathway via inhibition of IKBKE activity / symbiont-mediated suppression of host cytoplasmic pattern recognition receptor signaling pathway via inhibition of IRF7 activity / symbiont-mediated suppression of host antigen processing and presentation of peptide antigen via MHC class II / symbiont-mediated suppression of host PKR/eIFalpha signaling / positive regulation of protein sumoylation / viral RNA genome packaging / helical viral capsid / viral transcription / molecular sequestering activity / symbiont-mediated suppression of host JAK-STAT cascade via inhibition of STAT1 activity / viral genome replication / viral budding from plasma membrane / viral nucleocapsid / symbiont-mediated suppression of host cytoplasmic pattern recognition receptor signaling pathway via inhibition of TBK1 activity / symbiont-mediated suppression of host toll-like receptor signaling pathway / host cell cytoplasm / symbiont-mediated suppression of host innate immune response / symbiont-mediated suppression of host type I interferon-mediated signaling pathway / ribonucleoprotein complex / negative regulation of gene expression / host cell plasma membrane / virion membrane / structural molecule activity / RNA binding / membrane Similarity search - Function | ||||||||||||||||||||||||||||||||||||||||||||||||
| Biological species |   1976 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Method | ELECTRON MICROSCOPY / subtomogram averaging / cryo EM / Resolution: 8.9 Å | ||||||||||||||||||||||||||||||||||||||||||||||||
 Authors Authors | Watanabe, R. / Zyla, D. / Saphire, E.O. | ||||||||||||||||||||||||||||||||||||||||||||||||
| Funding support | 1items
| ||||||||||||||||||||||||||||||||||||||||||||||||
 Citation Citation |  Journal: Cell / Year: 2024 Journal: Cell / Year: 2024Title: Intracellular Ebola virus nucleocapsid assembly revealed by in situ cryo-electron tomography. Authors: Reika Watanabe / Dawid Zyla / Diptiben Parekh / Connor Hong / Ying Jones / Sharon L Schendel / William Wan / Guillaume Castillon / Erica Ollmann Saphire /  Abstract: Filoviruses, including the Ebola and Marburg viruses, cause hemorrhagic fevers with up to 90% lethality. The viral nucleocapsid is assembled by polymerization of the nucleoprotein (NP) along the ...Filoviruses, including the Ebola and Marburg viruses, cause hemorrhagic fevers with up to 90% lethality. The viral nucleocapsid is assembled by polymerization of the nucleoprotein (NP) along the viral genome, together with the viral proteins VP24 and VP35. We employed cryo-electron tomography of cells transfected with viral proteins and infected with model Ebola virus to illuminate assembly intermediates, as well as a 9 Å map of the complete intracellular assembly. This structure reveals a previously unresolved third and outer layer of NP complexed with VP35. The intrinsically disordered region, together with the C-terminal domain of this outer layer of NP, provides the constant width between intracellular nucleocapsid bundles and likely functions as a flexible tether to the viral matrix protein in the virion. A comparison of intracellular nucleocapsids with prior in-virion nucleocapsid structures reveals that the nucleocapsid further condenses vertically in the virion. The interfaces responsible for nucleocapsid assembly are highly conserved and offer targets for broadly effective antivirals. | ||||||||||||||||||||||||||||||||||||||||||||||||
| History |
|
- Structure visualization
Structure visualization
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  8usn.cif.gz 8usn.cif.gz | 251.7 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb8usn.ent.gz pdb8usn.ent.gz | 150.1 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  8usn.json.gz 8usn.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/us/8usn https://data.pdbj.org/pub/pdb/validation_reports/us/8usn ftp://data.pdbj.org/pub/pdb/validation_reports/us/8usn ftp://data.pdbj.org/pub/pdb/validation_reports/us/8usn | HTTPS FTP |
|---|
-Related structure data
| Related structure data |  42509MC  8ustC M: map data used to model this data C: citing same article ( |
|---|---|
| Similar structure data | Similarity search - Function & homology  F&H Search F&H Search |
- Links
Links
- Assembly
Assembly
| Deposited unit | 
|
|---|---|
| 1 |
|
- Components
Components
| #1: Protein | Mass: 83387.500 Da / Num. of mol.: 3 Source method: isolated from a genetically manipulated source Details: The N-terminal part of nucleoprotein / Source: (gene. exp.)   Homo sapiens (human) / Strain (production host): HEK 293T / References: UniProt: P18272 Homo sapiens (human) / Strain (production host): HEK 293T / References: UniProt: P18272#2: RNA chain | Mass: 1930.277 Da / Num. of mol.: 2 Source method: isolated from a genetically manipulated source Details: Sample RNA sequence / Source: (gene. exp.)   Homo sapiens (human) / Strain (production host): HEK 293T Homo sapiens (human) / Strain (production host): HEK 293T#3: Protein | Mass: 28250.811 Da / Num. of mol.: 2 Source method: isolated from a genetically manipulated source Details: VP24 / Source: (gene. exp.)   Homo sapiens (human) / Strain (production host): HEK 293T / References: UniProt: Q05322 Homo sapiens (human) / Strain (production host): HEK 293T / References: UniProt: Q05322#4: Protein | Mass: 37403.277 Da / Num. of mol.: 2 Source method: isolated from a genetically manipulated source Details: C-terminal domain of VP35 / Source: (gene. exp.)   Homo sapiens (human) / Strain (production host): HEK 293T / References: UniProt: Q05127 Homo sapiens (human) / Strain (production host): HEK 293T / References: UniProt: Q05127Has protein modification | N | |
|---|
-Experimental details
-Experiment
| Experiment | Method: ELECTRON MICROSCOPY |
|---|---|
| EM experiment | Aggregation state: CELL / 3D reconstruction method: subtomogram averaging |
- Sample preparation
Sample preparation
| Component |
| ||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Molecular weight |
| ||||||||||||||||||||||||||||||||||||||||||
| Source (natural) |
| ||||||||||||||||||||||||||||||||||||||||||
| Source (recombinant) |
| ||||||||||||||||||||||||||||||||||||||||||
| Details of virus |
| ||||||||||||||||||||||||||||||||||||||||||
| Natural host |
| ||||||||||||||||||||||||||||||||||||||||||
| Buffer solution | pH: 7.2 | ||||||||||||||||||||||||||||||||||||||||||
| Specimen | Embedding applied: NO / Shadowing applied: NO / Staining applied: NO / Vitrification applied: YES Details: FIB-milled-plunge-frozen cell expressing EBOV NP(601-739 truncated), VP24 and VP35 | ||||||||||||||||||||||||||||||||||||||||||
| Specimen support | Grid material: COPPER / Grid mesh size: 200 divisions/in. / Grid type: Quantifoil | ||||||||||||||||||||||||||||||||||||||||||
| Vitrification | Cryogen name: ETHANE-PROPANE |
- Electron microscopy imaging
Electron microscopy imaging
| Experimental equipment |  Model: Titan Krios / Image courtesy: FEI Company |
|---|---|
| Microscopy | Model: FEI TITAN KRIOS |
| Electron gun | Electron source:  FIELD EMISSION GUN / Accelerating voltage: 300 kV / Illumination mode: FLOOD BEAM FIELD EMISSION GUN / Accelerating voltage: 300 kV / Illumination mode: FLOOD BEAM |
| Electron lens | Mode: BRIGHT FIELD / Nominal defocus max: 3500 nm / Nominal defocus min: 2500 nm / C2 aperture diameter: 70 µm |
| Specimen holder | Cryogen: NITROGEN / Specimen holder model: FEI TITAN KRIOS AUTOGRID HOLDER |
| Image recording | Electron dose: 3.5 e/Å2 / Avg electron dose per subtomogram: 160 e/Å2 / Film or detector model: GATAN K3 (6k x 4k) |
| EM imaging optics | Energyfilter name: GIF Bioquantum / Energyfilter slit width: 20 eV |
- Processing
Processing
| EM software |
| ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CTF correction | Type: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||||||||||||||
| Symmetry | Point symmetry: C1 (asymmetric) | ||||||||||||||||||||||||||||||||||||
| 3D reconstruction | Resolution: 8.9 Å / Resolution method: FSC 0.143 CUT-OFF / Num. of particles: 28000 / Symmetry type: POINT | ||||||||||||||||||||||||||||||||||||
| EM volume selection | Num. of tomograms: 25 / Num. of volumes extracted: 102000 | ||||||||||||||||||||||||||||||||||||
| Atomic model building | Protocol: FLEXIBLE FIT |
 Movie
Movie Controller
Controller



 PDBj
PDBj