+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 8qut | ||||||
|---|---|---|---|---|---|---|---|
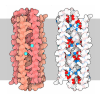
| タイトル | Cryo-EM structure of the heat-irreversible amyloid fibrils of human lysozyme | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード | PROTEIN FIBRIL / amyloid / irreversible | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報antimicrobial humoral response / Antimicrobial peptides / specific granule lumen / azurophil granule lumen / lysozyme / lysozyme activity / tertiary granule lumen / defense response to Gram-negative bacterium / killing of cells of another organism / defense response to Gram-positive bacterium ...antimicrobial humoral response / Antimicrobial peptides / specific granule lumen / azurophil granule lumen / lysozyme / lysozyme activity / tertiary granule lumen / defense response to Gram-negative bacterium / killing of cells of another organism / defense response to Gram-positive bacterium / defense response to bacterium / inflammatory response / Amyloid fiber formation / Neutrophil degranulation / extracellular space / extracellular exosome / extracellular region / identical protein binding 類似検索 - 分子機能 | ||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 | 電子顕微鏡法 / らせん対称体再構成法 / クライオ電子顕微鏡法 / 解像度: 2.8 Å | ||||||
 データ登録者 データ登録者 | Frey, L. / Greenwald, J. / Riek, R. | ||||||
| 資金援助 |  スイス, 1件 スイス, 1件
| ||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2024 ジャーナル: Nat Commun / 年: 2024タイトル: A structural rationale for reversible vs irreversible amyloid fibril formation from a single protein. 著者: Lukas Frey / Jiangtao Zhou / Gea Cereghetti / Marco E Weber / David Rhyner / Aditya Pokharna / Luca Wenchel / Harindranath Kadavath / Yiping Cao / Beat H Meier / Matthias Peter / Jason ...著者: Lukas Frey / Jiangtao Zhou / Gea Cereghetti / Marco E Weber / David Rhyner / Aditya Pokharna / Luca Wenchel / Harindranath Kadavath / Yiping Cao / Beat H Meier / Matthias Peter / Jason Greenwald / Roland Riek / Raffaele Mezzenga /    要旨: Reversible and irreversible amyloids are two diverging cases of protein (mis)folding associated with the cross-β motif in the protein folding and aggregation energy landscape. Yet, the molecular ...Reversible and irreversible amyloids are two diverging cases of protein (mis)folding associated with the cross-β motif in the protein folding and aggregation energy landscape. Yet, the molecular origins responsible for the formation of reversible vs irreversible amyloids have remained unknown. Here we provide evidence at the atomic level of distinct folding motifs for irreversible and reversible amyloids derived from a single protein sequence: human lysozyme. We compare the 2.8 Å structure of irreversible amyloid fibrils determined by cryo-electron microscopy helical reconstructions with molecular insights gained by solid-state NMR spectroscopy on reversible amyloids. We observe a canonical cross-β-sheet structure in irreversible amyloids, whereas in reversible amyloids, there is a less-ordered coexistence of β-sheet and helical secondary structures that originate from a partially unfolded lysozyme, thus carrying a "memory" of the original folded protein precursor. We also report the structure of hen egg-white lysozyme irreversible amyloids at 3.2 Å resolution, revealing another canonical amyloid fold, and reaffirming that irreversible amyloids undergo a complete conversion of the native protein into the cross-β structure. By combining atomic force microscopy, cryo-electron microscopy and solid-state NMR, we show that a full unfolding of the native protein precursor is a requirement for establishing irreversible amyloid fibrils. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  8qut.cif.gz 8qut.cif.gz | 126.4 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb8qut.ent.gz pdb8qut.ent.gz | 79.1 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  8qut.json.gz 8qut.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  8qut_validation.pdf.gz 8qut_validation.pdf.gz | 1001.5 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  8qut_full_validation.pdf.gz 8qut_full_validation.pdf.gz | 1002.2 KB | 表示 | |
| XML形式データ |  8qut_validation.xml.gz 8qut_validation.xml.gz | 28.1 KB | 表示 | |
| CIF形式データ |  8qut_validation.cif.gz 8qut_validation.cif.gz | 40.3 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/qu/8qut https://data.pdbj.org/pub/pdb/validation_reports/qu/8qut ftp://data.pdbj.org/pub/pdb/validation_reports/qu/8qut ftp://data.pdbj.org/pub/pdb/validation_reports/qu/8qut | HTTPS FTP |
-関連構造データ
| 関連構造データ |  18663MC  8qv8C M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
| #1: タンパク質 | 分子量: 14720.693 Da / 分子数: 5 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: LYZ / 発現宿主: Homo sapiens (ヒト) / 遺伝子: LYZ / 発現宿主:  #2: タンパク質・ペプチド | 分子量: 869.063 Da / 分子数: 5 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 発現宿主: Homo sapiens (ヒト) / 発現宿主:  研究の焦点であるリガンドがあるか | N | Has protein modification | N | |
|---|
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: FILAMENT / 3次元再構成法: らせん対称体再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: lysozyme amyloid fibril / タイプ: COMPLEX / Entity ID: all / 由来: RECOMBINANT |
|---|---|
| 分子量 | 実験値: NO |
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 由来(組換発現) | 生物種:  |
| 緩衝液 | pH: 7 / 詳細: 20mM DTT |
| 試料 | 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES |
| 急速凍結 | 凍結剤: ETHANE-PROPANE |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD / 倍率(公称値): 130000 X / 最大 デフォーカス(公称値): 3000 nm / 最小 デフォーカス(公称値): 800 nm / Cs: 2.7 mm / C2レンズ絞り径: 70 µm / アライメント法: COMA FREE |
| 試料ホルダ | 凍結剤: NITROGEN 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER |
| 撮影 | 平均露光時間: 1 sec. / 電子線照射量: 62.79 e/Å2 フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 実像数: 926 |
| 電子光学装置 | エネルギーフィルター名称: GIF Bioquantum / エネルギーフィルタースリット幅: 20 eV |
- 解析
解析
| EMソフトウェア |
| ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||
| らせん対称 | 回転角度/サブユニット: -1 ° / 軸方向距離/サブユニット: 4.78 Å / らせん対称軸の対称性: C1 | ||||||||||||||||
| 3次元再構成 | 解像度: 2.8 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 51695 / 対称性のタイプ: HELICAL | ||||||||||||||||
| 原子モデル構築 | プロトコル: AB INITIO MODEL / 空間: REAL |
 ムービー
ムービー コントローラー
コントローラー




 PDBj
PDBj