+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 8qn6 | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Amyloid-beta 40 type 2 filament from the leptomeninges of individual with Alzheimer's disease and cerebral amyloid angiopathy | ||||||||||||
 要素 要素 | Amyloid-beta A4 protein | ||||||||||||
 キーワード キーワード | PROTEIN FIBRIL / amyloid-beta / amyloid / filaments / quadruplet / Abeta40 / human brain / cryo-EM / Alzheimer's disease / cerebral amyloid angiopathy | ||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報signaling receptor activator activity / Golgi-associated vesicle / clathrin-coated pit / axonogenesis / central nervous system development / heparin binding / growth cone / perikaryon / early endosome / membrane raft ...signaling receptor activator activity / Golgi-associated vesicle / clathrin-coated pit / axonogenesis / central nervous system development / heparin binding / growth cone / perikaryon / early endosome / membrane raft / signaling receptor binding / cell surface / Golgi apparatus / endoplasmic reticulum / extracellular region / nucleus / plasma membrane 類似検索 - 分子機能 | ||||||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||||||||
| 手法 | 電子顕微鏡法 / らせん対称体再構成法 / クライオ電子顕微鏡法 / 解像度: 2.4 Å | ||||||||||||
 データ登録者 データ登録者 | Yang, Y. / Murzin, A.S. / Peak-Chew, S.Y. / Franco, C. / Newell, K.L. / Ghetti, B. / Goedert, M. / Scheres, S.H.W. | ||||||||||||
| 資金援助 |  英国, 3件 英国, 3件
| ||||||||||||
 引用 引用 |  ジャーナル: Acta Neuropathol Commun / 年: 2023 ジャーナル: Acta Neuropathol Commun / 年: 2023タイトル: Cryo-EM structures of Aβ40 filaments from the leptomeninges of individuals with Alzheimer's disease and cerebral amyloid angiopathy. 著者: Yang Yang / Alexey G Murzin / Sew Peak-Chew / Catarina Franco / Holly J Garringer / Kathy L Newell / Bernardino Ghetti / Michel Goedert / Sjors H W Scheres /   要旨: We used electron cryo-microscopy (cryo-EM) to determine the structures of Aβ40 filaments from the leptomeninges of individuals with Alzheimer's disease and cerebral amyloid angiopathy. In agreement ...We used electron cryo-microscopy (cryo-EM) to determine the structures of Aβ40 filaments from the leptomeninges of individuals with Alzheimer's disease and cerebral amyloid angiopathy. In agreement with previously reported structures, which were solved to a resolution of 4.4 Å, we found three types of filaments. However, our new structures, solved to a resolution of 2.4 Å, revealed differences in the sequence assignment that redefine the fold of Aβ40 peptides and their interactions. Filaments are made of pairs of protofilaments, the ordered core of which comprises D1-G38. The different filament types comprise one, two or three protofilament pairs. In each pair, residues H14-G37 of both protofilaments adopt an extended conformation and pack against each other in an anti-parallel fashion, held together by hydrophobic interactions and hydrogen bonds between main chains and side chains. Residues D1-H13 fold back on the adjacent parts of their own chains through both polar and non-polar interactions. There are also several additional densities of unknown identity. Sarkosyl extraction and aqueous extraction gave the same structures. By cryo-EM, parenchymal deposits of Aβ42 and blood vessel deposits of Aβ40 have distinct structures, supporting the view that Alzheimer's disease and cerebral amyloid angiopathy are different Aβ proteinopathies. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  8qn6.cif.gz 8qn6.cif.gz | 26.7 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb8qn6.ent.gz pdb8qn6.ent.gz | 15.2 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  8qn6.json.gz 8qn6.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/qn/8qn6 https://data.pdbj.org/pub/pdb/validation_reports/qn/8qn6 ftp://data.pdbj.org/pub/pdb/validation_reports/qn/8qn6 ftp://data.pdbj.org/pub/pdb/validation_reports/qn/8qn6 | HTTPS FTP |
|---|
-関連構造データ
| 関連構造データ |  18508MC  8qn7C M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | x 6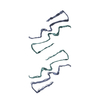
| ||||||||||||||||||||||||
| 非結晶学的対称性 (NCS) | NCS oper:
|
- 要素
要素
| #1: タンパク質・ペプチド | 分子量: 4335.852 Da / 分子数: 2 / 由来タイプ: 天然 / 由来: (天然)  Homo sapiens (ヒト) / 参照: UniProt: B4DM00 Homo sapiens (ヒト) / 参照: UniProt: B4DM00 |
|---|
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: FILAMENT / 3次元再構成法: らせん対称体再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: Amyloid-beta 40 / タイプ: TISSUE / Entity ID: all / 由来: NATURAL |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 緩衝液 | pH: 7.5 |
| 試料 | 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES |
| 急速凍結 | 凍結剤: ETHANE |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2400 nm / 最小 デフォーカス(公称値): 1000 nm |
| 撮影 | 電子線照射量: 40 e/Å2 フィルム・検出器のモデル: FEI FALCON IV (4k x 4k) |
- 解析
解析
| EMソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| らせん対称 | 回転角度/サブユニット: -0.78 ° / 軸方向距離/サブユニット: 4.87 Å / らせん対称軸の対称性: C2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3次元再構成 | 解像度: 2.4 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 81140 / 対称性のタイプ: HELICAL | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子モデル構築 | PDB-ID: 7Q4B Accession code: 7Q4B / Source name: PDB / タイプ: experimental model | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 | 解像度: 2.4→142.85 Å / Cor.coef. Fo:Fc: 0.768 / SU B: 5.681 / SU ML: 0.127 / ESU R: 0.086 立体化学のターゲット値: MAXIMUM LIKELIHOOD WITH PHASES 詳細: HYDROGENS HAVE BEEN USED IF PRESENT IN THE INPUT
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | 溶媒モデル: PARAMETERS FOR MASK CACLULATION | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 64.292 Å2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: 1 / 合計: 582 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー




 PDBj
PDBj