+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 8eyi | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
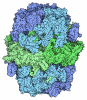
| タイトル | Atomic model of the core modifying region of human fatty acid synthase | |||||||||
 要素 要素 | Fatty acid synthase | |||||||||
 キーワード キーワード | TRANSFERASE / Fatty acid synthase | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報fatty-acid synthase system / ether lipid biosynthetic process / Vitamin B5 (pantothenate) metabolism / neutrophil differentiation / fatty-acyl-CoA biosynthetic process / enoyl-[acyl-carrier-protein] reductase (NADPH, Re-specific) / glandular epithelial cell development / establishment of endothelial intestinal barrier / [acyl-carrier-protein] S-acetyltransferase / [acyl-carrier-protein] S-acetyltransferase activity ...fatty-acid synthase system / ether lipid biosynthetic process / Vitamin B5 (pantothenate) metabolism / neutrophil differentiation / fatty-acyl-CoA biosynthetic process / enoyl-[acyl-carrier-protein] reductase (NADPH, Re-specific) / glandular epithelial cell development / establishment of endothelial intestinal barrier / [acyl-carrier-protein] S-acetyltransferase / [acyl-carrier-protein] S-acetyltransferase activity / glycogen granule / Fatty acyl-CoA biosynthesis / oleoyl-[acyl-carrier-protein] hydrolase / fatty acyl-[ACP] hydrolase activity / modulation by host of viral process / ChREBP activates metabolic gene expression / [acyl-carrier-protein] S-malonyltransferase / 3-hydroxyacyl-[acyl-carrier-protein] dehydratase / enoyl-[acyl-carrier-protein] reductase (NADPH) activity / [acyl-carrier-protein] S-malonyltransferase activity / beta-ketoacyl-[acyl-carrier-protein] synthase I / (3R)-hydroxyacyl-[acyl-carrier-protein] dehydratase activity / NR1H2 & NR1H3 regulate gene expression linked to lipogenesis / mammary gland development / 3-oxoacyl-[acyl-carrier-protein] reductase / 3-oxoacyl-[acyl-carrier-protein] reductase (NADPH) activity / fatty acid synthase activity / monocyte differentiation / phosphopantetheine binding / 3-oxoacyl-[acyl-carrier-protein] synthase activity / cellular response to interleukin-4 / Activation of gene expression by SREBF (SREBP) / fatty acid metabolic process / fatty acid biosynthetic process / osteoblast differentiation / melanosome / cadherin binding / inflammatory response / Golgi apparatus / RNA binding / extracellular exosome / membrane / plasma membrane / cytosol / cytoplasm 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.7 Å | |||||||||
 データ登録者 データ登録者 | Hasan, S.M.N. / Keszei, A. / Mazhab-Jafari, M.T. | |||||||||
| 資金援助 |  カナダ, 2件 カナダ, 2件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2023 ジャーナル: Nat Commun / 年: 2023タイトル: Atomic model for core modifying region of human fatty acid synthase in complex with Denifanstat. 著者: S M Naimul Hasan / Jennifer W Lou / Alexander F A Keszei / David L Dai / Mohammad T Mazhab-Jafari /  要旨: Fatty acid synthase (FASN) catalyzes the de novo synthesis of palmitate, a 16-carbon chain fatty acid that is the primary precursor of lipid metabolism and an important intracellular signaling ...Fatty acid synthase (FASN) catalyzes the de novo synthesis of palmitate, a 16-carbon chain fatty acid that is the primary precursor of lipid metabolism and an important intracellular signaling molecule. FASN is an attractive drug target in diabetes, cancer, fatty liver diseases, and viral infections. Here, we develop an engineered full-length human FASN (hFASN) that enables isolation of the condensing and modifying regions of the protein post-translation. The engineered protein enables electron cryo-microscopy (cryoEM) structure determination of the core modifying region of hFASN to 2.7 Å resolution. Examination of the dehydratase dimer within this region reveals that unlike its close homolog, porcine FASN, the catalytic cavity is close-ended and is accessible only through one opening in the vicinity of the active site. The core modifying region exhibits two major global conformational variabilities that describe long-range bending and twisting motions of the complex in solution. Finally, we solved the structure of this region bound to an anti-cancer drug, Denifanstat (i.e., TVB-2640), demonstrating the utility of our approach as a platform for structure guided design of future hFASN small molecule inhibitors. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  8eyi.cif.gz 8eyi.cif.gz | 443 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb8eyi.ent.gz pdb8eyi.ent.gz | 333.8 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  8eyi.json.gz 8eyi.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  8eyi_validation.pdf.gz 8eyi_validation.pdf.gz | 1.4 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  8eyi_full_validation.pdf.gz 8eyi_full_validation.pdf.gz | 1.4 MB | 表示 | |
| XML形式データ |  8eyi_validation.xml.gz 8eyi_validation.xml.gz | 66.9 KB | 表示 | |
| CIF形式データ |  8eyi_validation.cif.gz 8eyi_validation.cif.gz | 98.8 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/ey/8eyi https://data.pdbj.org/pub/pdb/validation_reports/ey/8eyi ftp://data.pdbj.org/pub/pdb/validation_reports/ey/8eyi ftp://data.pdbj.org/pub/pdb/validation_reports/ey/8eyi | HTTPS FTP |
-関連構造データ
| 関連構造データ |  28690MC  8eykC  8gkcC M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
| #1: タンパク質 | 分子量: 182749.016 Da / 分子数: 2 / 断片: residues 855-2511 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: FASN, FAS / 発現宿主: Homo sapiens (ヒト) / 遺伝子: FASN, FAS / 発現宿主:  Homo sapiens (ヒト) Homo sapiens (ヒト)参照: UniProt: P49327, fatty-acid synthase system, [acyl-carrier-protein] S-acetyltransferase, [acyl-carrier-protein] S-malonyltransferase, beta-ketoacyl-[acyl-carrier-protein] synthase I, 3- ...参照: UniProt: P49327, fatty-acid synthase system, [acyl-carrier-protein] S-acetyltransferase, [acyl-carrier-protein] S-malonyltransferase, beta-ketoacyl-[acyl-carrier-protein] synthase I, 3-oxoacyl-[acyl-carrier-protein] reductase, 3-hydroxyacyl-[acyl-carrier-protein] dehydratase, enoyl-[acyl-carrier-protein] reductase (NADPH, Re-specific), oleoyl-[acyl-carrier-protein] hydrolase #2: 化合物 | ChemComp-NDP / 研究の焦点であるリガンドがあるか | Y | |
|---|
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: Fatty acid synthase / タイプ: COMPLEX / Entity ID: #1 / 由来: RECOMBINANT |
|---|---|
| 分子量 | 値: 0.34 MDa / 実験値: YES |
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 由来(組換発現) | 生物種:  Homo sapiens (ヒト) / 細胞: HEK293 / プラスミド: pcDNA3.1 Homo sapiens (ヒト) / 細胞: HEK293 / プラスミド: pcDNA3.1 |
| 緩衝液 | pH: 7.4 |
| 試料 | 濃度: 0.8 mg/ml / 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES |
| 試料支持 | グリッドの材料: COPPER/RHODIUM / グリッドのサイズ: 400 divisions/in. / グリッドのタイプ: Homemade |
| 急速凍結 | 装置: FEI VITROBOT MARK IV / 凍結剤: ETHANE / 湿度: 100 % / 凍結前の試料温度: 277 K |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2500 nm / 最小 デフォーカス(公称値): 600 nm / Cs: 2.7 mm |
| 撮影 | 電子線照射量: 50.76 e/Å2 フィルム・検出器のモデル: FEI FALCON IV (4k x 4k) 撮影したグリッド数: 1 / 実像数: 4016 |
- 解析
解析
| ソフトウェア | 名称: PHENIX / バージョン: 1.20.1_4487: / 分類: 精密化 | ||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| EMソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 点対称性: C1 (非対称) | ||||||||||||||||||||||||||||||||||||||||||||||||||
| 3次元再構成 | 解像度: 2.7 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 355649 / 対称性のタイプ: POINT | ||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子モデル構築 | プロトコル: FLEXIBLE FIT / 空間: REAL | ||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー





 PDBj
PDBj