+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 7nah | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
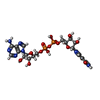
| タイトル | Crystal structure of the TIR domain from human SARM1 in complex with 2AD | |||||||||
 要素 要素 | Sterile alpha and TIR motif-containing protein 1 | |||||||||
 キーワード キーワード | HYDROLASE / NADase / Axon degeneration | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報extrinsic component of synaptic membrane / negative regulation of MyD88-independent toll-like receptor signaling pathway / NADP+ nucleosidase activity / MyD88-independent TLR4 cascade / Toll Like Receptor 3 (TLR3) Cascade / NAD+ catabolic process / NAD+ nucleosidase activity / regulation of synapse pruning / modification of postsynaptic structure / ADP-ribosyl cyclase/cyclic ADP-ribose hydrolase ...extrinsic component of synaptic membrane / negative regulation of MyD88-independent toll-like receptor signaling pathway / NADP+ nucleosidase activity / MyD88-independent TLR4 cascade / Toll Like Receptor 3 (TLR3) Cascade / NAD+ catabolic process / NAD+ nucleosidase activity / regulation of synapse pruning / modification of postsynaptic structure / ADP-ribosyl cyclase/cyclic ADP-ribose hydrolase / protein localization to mitochondrion / NAD+ nucleosidase activity, cyclic ADP-ribose generating / nervous system process / 加水分解酵素; 糖加水分解酵素; N-グリコシル化合物加水分解酵素 / regulation of dendrite morphogenesis / regulation of neuron apoptotic process / response to glucose / response to axon injury / TRAF6-mediated induction of TAK1 complex within TLR4 complex / Activation of IRF3, IRF7 mediated by TBK1, IKKε (IKBKE) / signaling adaptor activity / IKK complex recruitment mediated by RIP1 / neuromuscular junction / nervous system development / mitochondrial outer membrane / microtubule / cell differentiation / axon / innate immune response / synapse / dendrite / glutamatergic synapse / cell surface / signal transduction / protein-containing complex / mitochondrion / identical protein binding / cytosol / cytoplasm 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 1.79 Å 分子置換 / 解像度: 1.79 Å | |||||||||
 データ登録者 データ登録者 | Shi, Y. / Ve, T. | |||||||||
| 資金援助 |  オーストラリア, 2件 オーストラリア, 2件
| |||||||||
 引用 引用 |  ジャーナル: Mol Cell / 年: 2022 ジャーナル: Mol Cell / 年: 2022タイトル: Structural basis of SARM1 activation, substrate recognition, and inhibition by small molecules. 著者: Yun Shi / Philip S Kerry / Jeffrey D Nanson / Todd Bosanac / Yo Sasaki / Raul Krauss / Forhad K Saikot / Sarah E Adams / Tamim Mosaiab / Veronika Masic / Xianrong Mao / Faith Rose / Eduardo ...著者: Yun Shi / Philip S Kerry / Jeffrey D Nanson / Todd Bosanac / Yo Sasaki / Raul Krauss / Forhad K Saikot / Sarah E Adams / Tamim Mosaiab / Veronika Masic / Xianrong Mao / Faith Rose / Eduardo Vasquez / Marieke Furrer / Katie Cunnea / Andrew Brearley / Weixi Gu / Zhenyao Luo / Lou Brillault / Michael J Landsberg / Aaron DiAntonio / Bostjan Kobe / Jeffrey Milbrandt / Robert O Hughes / Thomas Ve /     要旨: The NADase SARM1 (sterile alpha and TIR motif containing 1) is a key executioner of axon degeneration and a therapeutic target for several neurodegenerative conditions. We show that a potent SARM1 ...The NADase SARM1 (sterile alpha and TIR motif containing 1) is a key executioner of axon degeneration and a therapeutic target for several neurodegenerative conditions. We show that a potent SARM1 inhibitor undergoes base exchange with the nicotinamide moiety of nicotinamide adenine dinucleotide (NAD) to produce the bona fide inhibitor 1AD. We report structures of SARM1 in complex with 1AD, NAD mimetics and the allosteric activator nicotinamide mononucleotide (NMN). NMN binding triggers reorientation of the armadillo repeat (ARM) domains, which disrupts ARM:TIR interactions and leads to formation of a two-stranded TIR domain assembly. The active site spans two molecules in these assemblies, explaining the requirement of TIR domain self-association for NADase activity and axon degeneration. Our results reveal the mechanisms of SARM1 activation and substrate binding, providing rational avenues for the design of new therapeutics targeting SARM1. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  7nah.cif.gz 7nah.cif.gz | 129.5 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb7nah.ent.gz pdb7nah.ent.gz | 100 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  7nah.json.gz 7nah.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  7nah_validation.pdf.gz 7nah_validation.pdf.gz | 1.2 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  7nah_full_validation.pdf.gz 7nah_full_validation.pdf.gz | 1.2 MB | 表示 | |
| XML形式データ |  7nah_validation.xml.gz 7nah_validation.xml.gz | 14.7 KB | 表示 | |
| CIF形式データ |  7nah_validation.cif.gz 7nah_validation.cif.gz | 20.8 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/na/7nah https://data.pdbj.org/pub/pdb/validation_reports/na/7nah ftp://data.pdbj.org/pub/pdb/validation_reports/na/7nah ftp://data.pdbj.org/pub/pdb/validation_reports/na/7nah | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 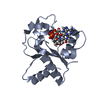
| ||||||||||||
| 2 | 
| ||||||||||||
| 単位格子 |
| ||||||||||||
| Components on special symmetry positions |
|
- 要素
要素
| #1: タンパク質 | 分子量: 16333.703 Da / 分子数: 2 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: SARM1, KIAA0524, SAMD2, SARM / 発現宿主: Homo sapiens (ヒト) / 遺伝子: SARM1, KIAA0524, SAMD2, SARM / 発現宿主:  #2: 化合物 | #3: 水 | ChemComp-HOH / | 研究の焦点であるリガンドがあるか | Y | |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.53 Å3/Da / 溶媒含有率: 51.42 % |
|---|---|
| 結晶化 | 温度: 293 K / 手法: 蒸気拡散法, ハンギングドロップ法 詳細: 0.1 M Bis-Tris propane pH 7.0, 0.2 M potassium thiocyanate, and 10% PEG3350 |
-データ収集
| 回折 | 平均測定温度: 100 K / Serial crystal experiment: N |
|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  Australian Synchrotron Australian Synchrotron  / ビームライン: MX2 / 波長: 0.9537 Å / ビームライン: MX2 / 波長: 0.9537 Å |
| 検出器 | タイプ: DECTRIS EIGER X 16M / 検出器: PIXEL / 日付: 2020年11月7日 |
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長: 0.9537 Å / 相対比: 1 |
| 反射 | 解像度: 1.79→48.29 Å / Num. obs: 32174 / % possible obs: 99.9 % / 冗長度: 6.7 % / Biso Wilson estimate: 17.89 Å2 / CC1/2: 0.999 / Rmerge(I) obs: 0.074 / Rpim(I) all: 0.031 / Rrim(I) all: 0.08 / Net I/σ(I): 12.8 |
| 反射 シェル | 解像度: 1.79→1.83 Å / Rmerge(I) obs: 0.413 / Mean I/σ(I) obs: 3.1 / Num. unique obs: 1854 / CC1/2: 0.944 / Rpim(I) all: 0.169 / Rrim(I) all: 0.446 |
- 解析
解析
| ソフトウェア |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  分子置換 分子置換開始モデル: 6O0R 解像度: 1.79→43.12 Å / SU ML: 0.2017 / 交差検証法: FREE R-VALUE / σ(F): 1.35 / 位相誤差: 17.2791 立体化学のターゲット値: GeoStd + Monomer Library + CDL v1.2
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | 減衰半径: 0.9 Å / VDWプローブ半径: 1.11 Å / 溶媒モデル: FLAT BULK SOLVENT MODEL | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 20.94 Å2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 1.79→43.12 Å
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル |
|
 ムービー
ムービー コントローラー
コントローラー











 PDBj
PDBj