| 登録情報 | データベース: PDB / ID: 7l6k
|
|---|
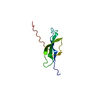
| タイトル | ApoL1 N-terminal domain |
|---|
 要素 要素 | Apolipoprotein L1 |
|---|
 キーワード キーワード | MEMBRANE PROTEIN / Ion channel / kidney disease / lipoprotein |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
lipoprotein metabolic process / high-density lipoprotein particle / very-low-density lipoprotein particle / lipid transport / cytolysis by host of symbiont cells / chloride channel activity / Scavenging of heme from plasma / cholesterol metabolic process / chloride transmembrane transport / Post-translational protein phosphorylation ...lipoprotein metabolic process / high-density lipoprotein particle / very-low-density lipoprotein particle / lipid transport / cytolysis by host of symbiont cells / chloride channel activity / Scavenging of heme from plasma / cholesterol metabolic process / chloride transmembrane transport / Post-translational protein phosphorylation / Regulation of Insulin-like Growth Factor (IGF) transport and uptake by Insulin-like Growth Factor Binding Proteins (IGFBPs) / blood microparticle / endoplasmic reticulum lumen / innate immune response / lipid binding / extracellular space / extracellular region / membrane類似検索 - 分子機能 |
|---|
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) |
|---|
| 手法 | 溶液NMR / simulated annealing |
|---|
 データ登録者 データ登録者 | Holliday, M.J. / Ultsch, M. / Moran, P. / Fairbrother, W.J. / Kirchhofer, D. |
|---|
 引用 引用 |  ジャーナル: Commun Biol / 年: 2021 ジャーナル: Commun Biol / 年: 2021
タイトル: Structures of the ApoL1 and ApoL2 N-terminal domains reveal a non-classical four-helix bundle motif.
著者: Ultsch, M. / Holliday, M.J. / Gerhardy, S. / Moran, P. / Scales, S.J. / Gupta, N. / Oltrabella, F. / Chiu, C. / Fairbrother, W. / Eigenbrot, C. / Kirchhofer, D. |
|---|
| 履歴 | | 登録 | 2020年12月23日 | 登録サイト: RCSB / 処理サイト: RCSB |
|---|
| 改定 1.0 | 2021年8月4日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2021年8月25日 | Group: Database references / カテゴリ: citation / citation_author / database_2
Item: _citation.country / _citation.journal_abbrev ..._citation.country / _citation.journal_abbrev / _citation.journal_id_CSD / _citation.journal_id_ISSN / _citation.journal_volume / _citation.page_first / _citation.page_last / _citation.pdbx_database_id_DOI / _citation.pdbx_database_id_PubMed / _citation.title / _citation.year / _citation_author.identifier_ORCID / _citation_author.name / _database_2.pdbx_DOI / _database_2.pdbx_database_accession |
|---|
| 改定 1.2 | 2023年6月14日 | Group: Other / カテゴリ: pdbx_database_status / Item: _pdbx_database_status.status_code_nmr_data |
|---|
| 改定 1.3 | 2024年5月15日 | Group: Data collection / Database references / カテゴリ: chem_comp_atom / chem_comp_bond / database_2 / Item: _database_2.pdbx_DOI |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) データ登録者
データ登録者 引用
引用 ジャーナル: Commun Biol / 年: 2021
ジャーナル: Commun Biol / 年: 2021 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 7l6k.cif.gz
7l6k.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb7l6k.ent.gz
pdb7l6k.ent.gz PDB形式
PDB形式 7l6k.json.gz
7l6k.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 7l6k_validation.pdf.gz
7l6k_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 7l6k_full_validation.pdf.gz
7l6k_full_validation.pdf.gz 7l6k_validation.xml.gz
7l6k_validation.xml.gz 7l6k_validation.cif.gz
7l6k_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/l6/7l6k
https://data.pdbj.org/pub/pdb/validation_reports/l6/7l6k ftp://data.pdbj.org/pub/pdb/validation_reports/l6/7l6k
ftp://data.pdbj.org/pub/pdb/validation_reports/l6/7l6k




 リンク
リンク 集合体
集合体
 要素
要素 Homo sapiens (ヒト) / 遺伝子: APOL1, APOL / 発現宿主:
Homo sapiens (ヒト) / 遺伝子: APOL1, APOL / 発現宿主: 
 試料調製
試料調製 解析
解析 ムービー
ムービー コントローラー
コントローラー











 PDBj
PDBj










 gel filtration
gel filtration