| 登録情報 | データベース: PDB / ID: 6z0e
|
|---|
| タイトル | HtrA1 inactive protease domain S328A with CARASIL mutation R274Q |
|---|
 要素 要素 | Serine protease HTRA1 |
|---|
 キーワード キーワード | HYDROLASE / Hydrolase Protease HtrA family CARASIL mutations trimerization |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
chorionic trophoblast cell differentiation / programmed cell death / growth factor binding / 加水分解酵素; プロテアーゼ; ペプチド結合加水分解酵素; セリンエンドペプチターゼ / negative regulation of BMP signaling pathway / Degradation of the extracellular matrix / serine-type peptidase activity / molecular function activator activity / placenta development / negative regulation of transforming growth factor beta receptor signaling pathway ...chorionic trophoblast cell differentiation / programmed cell death / growth factor binding / 加水分解酵素; プロテアーゼ; ペプチド結合加水分解酵素; セリンエンドペプチターゼ / negative regulation of BMP signaling pathway / Degradation of the extracellular matrix / serine-type peptidase activity / molecular function activator activity / placenta development / negative regulation of transforming growth factor beta receptor signaling pathway / : / positive regulation of apoptotic process / serine-type endopeptidase activity / proteolysis / extracellular space / extracellular exosome / extracellular region / identical protein binding / plasma membrane / cytosol類似検索 - 分子機能 Insulin-like growth factor binding protein / Insulin-like growth factor-binding protein, IGFBP / Insulin-like growth factor-binding protein (IGFBP) N-terminal domain profile. / Insulin growth factor-binding protein homologues / Kazal-type serine protease inhibitor domain / PDZ domain 6 / Kazal type serine protease inhibitors / PDZ domain / Peptidase S1C / Kazal domain superfamily ...Insulin-like growth factor binding protein / Insulin-like growth factor-binding protein, IGFBP / Insulin-like growth factor-binding protein (IGFBP) N-terminal domain profile. / Insulin growth factor-binding protein homologues / Kazal-type serine protease inhibitor domain / PDZ domain 6 / Kazal type serine protease inhibitors / PDZ domain / Peptidase S1C / Kazal domain superfamily / Trypsin-like peptidase domain / Kazal domain / Kazal domain profile. / Growth factor receptor cysteine-rich domain superfamily / PDZ domain profile. / Domain present in PSD-95, Dlg, and ZO-1/2. / PDZ domain / PDZ superfamily / Peptidase S1, PA clan類似検索 - ドメイン・相同性 |
|---|
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) |
|---|
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 2.6 Å 分子置換 / 解像度: 2.6 Å |
|---|
 データ登録者 データ登録者 | Vetter, I.R. / Stege, P. / Ingendahl, L. / Ehrmann, M. |
|---|
| 資金援助 |  ドイツ, 1件 ドイツ, 1件 | 組織 | 認可番号 | 国 |
|---|
| German Research Foundation (DFG) | CRC1093 |  ドイツ ドイツ |
|
|---|
 引用 引用 |  ジャーナル: To Be Published ジャーナル: To Be Published
タイトル: Repair strategies addressing pathogenic protein conformations
著者: Ingendahl, L. / Beaufort, N. / Kuszner, M. / Vetter, I.R. / Stege, P. / Ruiz-Blanco, Y.B. / Bravo-Rodriguez, K. / Beuck, C. / Schillinger, J. / Rey, J. / Roberti, A. / Hagemeier, B. / Hu, X.- ...著者: Ingendahl, L. / Beaufort, N. / Kuszner, M. / Vetter, I.R. / Stege, P. / Ruiz-Blanco, Y.B. / Bravo-Rodriguez, K. / Beuck, C. / Schillinger, J. / Rey, J. / Roberti, A. / Hagemeier, B. / Hu, X.-Y. / Clausen, T. / Sanchez-Garcia, E. / Schmuck, C. / Dichgans, M. / Ehrmann, M. |
|---|
| 履歴 | | 登録 | 2020年5月8日 | 登録サイト: PDBE / 処理サイト: PDBE |
|---|
| 改定 1.0 | 2021年5月19日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2024年1月24日 | Group: Data collection / Database references / Refinement description
カテゴリ: chem_comp_atom / chem_comp_bond ...chem_comp_atom / chem_comp_bond / database_2 / pdbx_initial_refinement_model
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  分子置換 / 解像度: 2.6 Å
分子置換 / 解像度: 2.6 Å  データ登録者
データ登録者 ドイツ, 1件
ドイツ, 1件  引用
引用 ジャーナル: To Be Published
ジャーナル: To Be Published 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 6z0e.cif.gz
6z0e.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb6z0e.ent.gz
pdb6z0e.ent.gz PDB形式
PDB形式 6z0e.json.gz
6z0e.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 6z0e_validation.pdf.gz
6z0e_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 6z0e_full_validation.pdf.gz
6z0e_full_validation.pdf.gz 6z0e_validation.xml.gz
6z0e_validation.xml.gz 6z0e_validation.cif.gz
6z0e_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/z0/6z0e
https://data.pdbj.org/pub/pdb/validation_reports/z0/6z0e ftp://data.pdbj.org/pub/pdb/validation_reports/z0/6z0e
ftp://data.pdbj.org/pub/pdb/validation_reports/z0/6z0e リンク
リンク 集合体
集合体
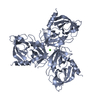

 要素
要素 Homo sapiens (ヒト) / 遺伝子: HTRA1, HTRA, PRSS11 / 発現宿主:
Homo sapiens (ヒト) / 遺伝子: HTRA1, HTRA, PRSS11 / 発現宿主: 
 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  SLS
SLS  / ビームライン: X10SA / 波長: 1 Å
/ ビームライン: X10SA / 波長: 1 Å 解析
解析 分子置換
分子置換 ムービー
ムービー コントローラー
コントローラー
















 PDBj
PDBj








