| 登録情報 | データベース: PDB / ID: 6xh0
|
|---|
| タイトル | Co-crystal structure of HIV-1 TAR RNA in complex with lab-evolved RRM TBP6.9 |
|---|
 要素 要素 | - TAR binding protein 6.9
- TRANS-ACTIVATION RESPONSE ELEMENT
|
|---|
 キーワード キーワード | RNA BINDING PROTEIN/RNA / PROTEIN-RNA COMPLEX / TAR RNA / LAB-EVOLVED PROTEIN / ARGININE FORK / BETA HAIRPIN / MAJOR-GROOVE READOUT / BASE TRIPLE / U1A / HIV-1 / TRANS- ACTIVATION / RNA RECOGNITION MOTIF / RRM / RNA BINDING PROTEIN-RNA COMPLEX / RNA BINDING PROTEIN |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
U1 snRNP binding / U1 snRNP / U1 snRNA binding / U4/U6 x U5 tri-snRNP complex / mRNA Splicing - Major Pathway / spliceosomal complex / mRNA splicing, via spliceosome / DNA binding / RNA binding / nucleoplasm ...U1 snRNP binding / U1 snRNP / U1 snRNA binding / U4/U6 x U5 tri-snRNP complex / mRNA Splicing - Major Pathway / spliceosomal complex / mRNA splicing, via spliceosome / DNA binding / RNA binding / nucleoplasm / identical protein binding / nucleus類似検索 - 分子機能 U1 small nuclear ribonucleoprotein A, RNA recognition motif 2 / U1 small nuclear ribonucleoprotein A, RNA recognition motif 1 / RNA recognition motif / RNA recognition motif / Eukaryotic RNA Recognition Motif (RRM) profile. / RNA recognition motif domain / RNA-binding domain superfamily / Nucleotide-binding alpha-beta plait domain superfamily類似検索 - ドメイン・相同性 RNA / RNA (> 10) / U1 small nuclear ribonucleoprotein A類似検索 - 構成要素 |
|---|
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト)
  Human immunodeficiency virus 1 (ヒト免疫不全ウイルス) Human immunodeficiency virus 1 (ヒト免疫不全ウイルス) |
|---|
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  フーリエ合成 / 解像度: 3.1 Å フーリエ合成 / 解像度: 3.1 Å |
|---|
 データ登録者 データ登録者 | Chavali, S.S. / Jenkins, J.L. / Wedekind, J.E. |
|---|
| 資金援助 |  米国, 1件 米国, 1件 | 組織 | 認可番号 | 国 |
|---|
| National Institutes of Health/National Institute of General Medical Sciences (NIH/NIGMS) | AI150463 |  米国 米国 |
|
|---|
 引用 引用 |  ジャーナル: J.Biol.Chem. / 年: 2020 ジャーナル: J.Biol.Chem. / 年: 2020
タイトル: Co-crystal structures of HIV TAR RNA bound to lab-evolved proteins show key roles for arginine relevant to the design of cyclic peptide TAR inhibitors.
著者: Chavali, S.S. / Mali, S.M. / Jenkins, J.L. / Fasan, R. / Wedekind, J.E. |
|---|
| 履歴 | | 登録 | 2020年6月18日 | 登録サイト: RCSB / 処理サイト: RCSB |
|---|
| 改定 1.0 | 2020年10月14日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2020年11月4日 | Group: Database references / カテゴリ: citation / citation_author
Item: _citation.country / _citation.journal_abbrev ..._citation.country / _citation.journal_abbrev / _citation.journal_id_ASTM / _citation.journal_id_CSD / _citation.journal_id_ISSN / _citation.pdbx_database_id_DOI / _citation.pdbx_database_id_PubMed / _citation.title / _citation.year / _citation_author.identifier_ORCID |
|---|
| 改定 1.2 | 2020年12月16日 | Group: Database references / カテゴリ: citation
Item: _citation.journal_volume / _citation.page_first / _citation.page_last |
|---|
| 改定 1.3 | 2024年3月6日 | Group: Data collection / Database references / カテゴリ: chem_comp_atom / chem_comp_bond / database_2
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト)
 Human immunodeficiency virus 1 (ヒト免疫不全ウイルス)
Human immunodeficiency virus 1 (ヒト免疫不全ウイルス) X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  フーリエ合成 / 解像度: 3.1 Å
フーリエ合成 / 解像度: 3.1 Å  データ登録者
データ登録者 米国, 1件
米国, 1件  引用
引用 ジャーナル: J.Biol.Chem. / 年: 2020
ジャーナル: J.Biol.Chem. / 年: 2020 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 6xh0.cif.gz
6xh0.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb6xh0.ent.gz
pdb6xh0.ent.gz PDB形式
PDB形式 6xh0.json.gz
6xh0.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 6xh0_validation.pdf.gz
6xh0_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 6xh0_full_validation.pdf.gz
6xh0_full_validation.pdf.gz 6xh0_validation.xml.gz
6xh0_validation.xml.gz 6xh0_validation.cif.gz
6xh0_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/xh/6xh0
https://data.pdbj.org/pub/pdb/validation_reports/xh/6xh0 ftp://data.pdbj.org/pub/pdb/validation_reports/xh/6xh0
ftp://data.pdbj.org/pub/pdb/validation_reports/xh/6xh0 リンク
リンク 集合体
集合体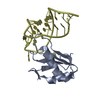
 要素
要素 Homo sapiens (ヒト) / 発現宿主:
Homo sapiens (ヒト) / 発現宿主: 

 Human immunodeficiency virus 1 (ヒト免疫不全ウイルス)
Human immunodeficiency virus 1 (ヒト免疫不全ウイルス) X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  SSRL
SSRL  / ビームライン: BL12-2 / 波長: 0.9795 Å
/ ビームライン: BL12-2 / 波長: 0.9795 Å 解析
解析 フーリエ合成 / 解像度: 3.1→38.966 Å / SU ML: 0.51 / 交差検証法: THROUGHOUT / σ(F): 1.35 / 位相誤差: 26.52 / 立体化学のターゲット値: ML
フーリエ合成 / 解像度: 3.1→38.966 Å / SU ML: 0.51 / 交差検証法: THROUGHOUT / σ(F): 1.35 / 位相誤差: 26.52 / 立体化学のターゲット値: ML ムービー
ムービー コントローラー
コントローラー














 PDBj
PDBj

































