| 登録情報 | データベース: PDB / ID: 6sm5
|
|---|
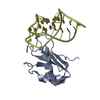
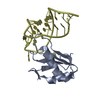
| タイトル | MbC/SHP1-C-SH2 complex |
|---|
 要素 要素 | - MbC (monobody targeting SHP1-C-SH2)
- Tyrosine-protein phosphatase non-receptor type 6
|
|---|
 キーワード キーワード | BIOSYNTHETIC PROTEIN / Complex / inhibitor / phosphatase / monobody |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
negative regulation of humoral immune response mediated by circulating immunoglobulin / epididymis development / negative regulation of mast cell activation involved in immune response / negative regulation of B cell receptor signaling pathway / regulation of B cell differentiation / CD27 signaling pathway / negative regulation of inflammatory response to wounding / transmembrane receptor protein tyrosine phosphatase activity / phosphorylation-dependent protein binding / Co-inhibition by BTLA ...negative regulation of humoral immune response mediated by circulating immunoglobulin / epididymis development / negative regulation of mast cell activation involved in immune response / negative regulation of B cell receptor signaling pathway / regulation of B cell differentiation / CD27 signaling pathway / negative regulation of inflammatory response to wounding / transmembrane receptor protein tyrosine phosphatase activity / phosphorylation-dependent protein binding / Co-inhibition by BTLA / negative regulation of lipopolysaccharide-mediated signaling pathway / negative regulation of neutrophil activation / CD22 mediated BCR regulation / alpha-beta T cell receptor complex / regulation of release of sequestered calcium ion into cytosol / Interleukin-37 signaling / positive regulation of cell adhesion mediated by integrin / Signal regulatory protein family interactions / platelet formation / Regulation of KIT signaling / megakaryocyte development / Signaling by ALK / negative regulation of T cell receptor signaling pathway / natural killer cell mediated cytotoxicity / Platelet sensitization by LDL / regulation of type I interferon-mediated signaling pathway / PECAM1 interactions / negative regulation of interleukin-6 production / peptidyl-tyrosine dephosphorylation / non-membrane spanning protein tyrosine phosphatase activity / regulation of G1/S transition of mitotic cell cycle / Regulation of IFNA/IFNB signaling / Interleukin-3, Interleukin-5 and GM-CSF signaling / Co-inhibition by PD-1 / negative regulation of tumor necrosis factor production / Interleukin receptor SHC signaling / Regulation of IFNG signaling / regulation of ERK1 and ERK2 cascade / T cell proliferation / Growth hormone receptor signaling / hematopoietic progenitor cell differentiation / protein dephosphorylation / Nuclear events stimulated by ALK signaling in cancer / GPVI-mediated activation cascade / negative regulation of MAPK cascade / cell adhesion molecule binding / negative regulation of T cell proliferation / T cell costimulation / phosphotyrosine residue binding / protein-tyrosine-phosphatase / SH2 domain binding / protein tyrosine phosphatase activity / negative regulation of innate immune response / Antigen activates B Cell Receptor (BCR) leading to generation of second messengers / T cell activation / peptidyl-tyrosine phosphorylation / negative regulation of angiogenesis / B cell receptor signaling pathway / SH3 domain binding / platelet aggregation / specific granule lumen / cytokine-mediated signaling pathway / Interferon gamma signaling / Interferon alpha/beta signaling / cell-cell junction / tertiary granule lumen / mitotic cell cycle / T cell receptor signaling pathway / MAPK cascade / regulation of apoptotic process / cell differentiation / positive regulation of phosphatidylinositol 3-kinase/protein kinase B signal transduction / G protein-coupled receptor signaling pathway / negative regulation of cell population proliferation / positive regulation of cell population proliferation / Neutrophil degranulation / protein kinase binding / nucleolus / SARS-CoV-2 activates/modulates innate and adaptive immune responses / protein-containing complex / extracellular exosome / extracellular region / nucleoplasm / nucleus / membrane / plasma membrane / cytosol / cytoplasm類似検索 - 分子機能 : / Protein-tyrosine phosphatase, non-receptor type-6, -11 / Protein tyrosine phosphatase, catalytic domain / PTP type protein phosphatase domain profile. / Protein-tyrosine phosphatase / Tyrosine-specific protein phosphatase, PTPase domain / Protein-tyrosine phosphatase, catalytic / Protein tyrosine phosphatase, catalytic domain motif / Tyrosine specific protein phosphatases active site. / Protein-tyrosine phosphatase, active site ...: / Protein-tyrosine phosphatase, non-receptor type-6, -11 / Protein tyrosine phosphatase, catalytic domain / PTP type protein phosphatase domain profile. / Protein-tyrosine phosphatase / Tyrosine-specific protein phosphatase, PTPase domain / Protein-tyrosine phosphatase, catalytic / Protein tyrosine phosphatase, catalytic domain motif / Tyrosine specific protein phosphatases active site. / Protein-tyrosine phosphatase, active site / Tyrosine specific protein phosphatases domain profile. / Tyrosine-specific protein phosphatases domain / Protein-tyrosine phosphatase-like / SH2 domain / Src homology 2 (SH2) domain profile. / Src homology 2 domains / SH2 domain / SH2 domain superfamily類似検索 - ドメイン・相同性 Tyrosine-protein phosphatase non-receptor type 6類似検索 - 構成要素 |
|---|
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト)
synthetic construct (人工物) |
|---|
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 2.75 Å 分子置換 / 解像度: 2.75 Å |
|---|
 データ登録者 データ登録者 | Mann, G. / Hantschel, O. |
|---|
| 資金援助 | 1件 | 組織 | 認可番号 | 国 |
|---|
| European Research Council | | |
|
|---|
 引用 引用 |  ジャーナル: To Be Published ジャーナル: To Be Published
タイトル: MbC/SHP1-C-SH2 complex
著者: Hantschel, O. |
|---|
| 履歴 | | 登録 | 2019年8月21日 | 登録サイト: PDBE / 処理サイト: PDBE |
|---|
| 改定 1.0 | 2021年1月13日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2024年1月24日 | Group: Data collection / Database references / Refinement description
カテゴリ: chem_comp_atom / chem_comp_bond ...chem_comp_atom / chem_comp_bond / database_2 / pdbx_initial_refinement_model
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  分子置換 / 解像度: 2.75 Å
分子置換 / 解像度: 2.75 Å  データ登録者
データ登録者 引用
引用 ジャーナル: To Be Published
ジャーナル: To Be Published 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 6sm5.cif.gz
6sm5.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb6sm5.ent.gz
pdb6sm5.ent.gz PDB形式
PDB形式 6sm5.json.gz
6sm5.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 6sm5_validation.pdf.gz
6sm5_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 6sm5_full_validation.pdf.gz
6sm5_full_validation.pdf.gz 6sm5_validation.xml.gz
6sm5_validation.xml.gz 6sm5_validation.cif.gz
6sm5_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/sm/6sm5
https://data.pdbj.org/pub/pdb/validation_reports/sm/6sm5 ftp://data.pdbj.org/pub/pdb/validation_reports/sm/6sm5
ftp://data.pdbj.org/pub/pdb/validation_reports/sm/6sm5
 リンク
リンク 集合体
集合体
 要素
要素 Homo sapiens (ヒト) / 遺伝子: PTPN6, HCP, PTP1C / 発現宿主:
Homo sapiens (ヒト) / 遺伝子: PTPN6, HCP, PTP1C / 発現宿主: 

 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  SLS
SLS  / ビームライン: X06DA / 波長: 1 Å
/ ビームライン: X06DA / 波長: 1 Å 解析
解析 分子置換
分子置換 ムービー
ムービー コントローラー
コントローラー











 PDBj
PDBj




























