+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 6pwn | ||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
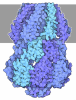
| タイトル | MscS Nanodisc with N-terminal His-Tag | ||||||||||||||||||||||||||||||||||||||||||
 要素 要素 | Small-conductance mechanosensitive channel | ||||||||||||||||||||||||||||||||||||||||||
 キーワード キーワード | MEMBRANE PROTEIN / MscS / Nanodisc / Mechanosensitive Channel of Small Conductance / Mechanosensitive / Channel | ||||||||||||||||||||||||||||||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報intracellular water homeostasis / mechanosensitive monoatomic ion channel activity / protein homooligomerization / monoatomic ion transmembrane transport / identical protein binding / membrane / plasma membrane 類似検索 - 分子機能 | ||||||||||||||||||||||||||||||||||||||||||
| 生物種 |  | ||||||||||||||||||||||||||||||||||||||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.1 Å | ||||||||||||||||||||||||||||||||||||||||||
 データ登録者 データ登録者 | Reddy, B.G. / Perozo, E. | ||||||||||||||||||||||||||||||||||||||||||
| 資金援助 |  米国, 1件 米国, 1件
| ||||||||||||||||||||||||||||||||||||||||||
 引用 引用 |  ジャーナル: Elife / 年: 2019 ジャーナル: Elife / 年: 2019タイトル: Molecular basis of force-from-lipids gating in the mechanosensitive channel MscS. 著者: Bharat Reddy / Navid Bavi / Allen Lu / Yeonwoo Park / Eduardo Perozo /  要旨: Prokaryotic mechanosensitive (MS) channels open by sensing the physical state of the membrane. As such, lipid-protein interactions represent the defining molecular process underlying ...Prokaryotic mechanosensitive (MS) channels open by sensing the physical state of the membrane. As such, lipid-protein interactions represent the defining molecular process underlying mechanotransduction. Here, we describe cryo-electron microscopy (cryo-EM) structures of the small-conductance mechanosensitive channel (MscS) in nanodiscs (ND). They reveal a novel membrane-anchoring fold that plays a significant role in channel activation and establish a new location for the lipid bilayer, shifted ~14 Å from previous consensus placements. Two types of lipid densities are explicitly observed. A phospholipid that 'hooks' the top of each TM2-TM3 hairpin and likely plays a role in force sensing, and a bundle of acyl chains occluding the permeation path above the L105 cuff. These observations reshape our understanding of force-from-lipids gating in MscS and highlight the key role of allosteric interactions between TM segments and phospholipids bound to key dynamic components of the channel. | ||||||||||||||||||||||||||||||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  6pwn.cif.gz 6pwn.cif.gz | 337.9 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb6pwn.ent.gz pdb6pwn.ent.gz | 279.7 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  6pwn.json.gz 6pwn.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  6pwn_validation.pdf.gz 6pwn_validation.pdf.gz | 1.1 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  6pwn_full_validation.pdf.gz 6pwn_full_validation.pdf.gz | 1.2 MB | 表示 | |
| XML形式データ |  6pwn_validation.xml.gz 6pwn_validation.xml.gz | 70.3 KB | 表示 | |
| CIF形式データ |  6pwn_validation.cif.gz 6pwn_validation.cif.gz | 90.7 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/pw/6pwn https://data.pdbj.org/pub/pdb/validation_reports/pw/6pwn ftp://data.pdbj.org/pub/pdb/validation_reports/pw/6pwn ftp://data.pdbj.org/pub/pdb/validation_reports/pw/6pwn | HTTPS FTP |
-関連構造データ
| 関連構造データ |  20508MC  6pwoC  6pwpC C: 同じ文献を引用 ( M: このデータのモデリングに利用したマップデータ |
|---|---|
| 類似構造データ | |
| 電子顕微鏡画像生データ |  EMPIAR-10496 (タイトル: MscS Nanodisc with N-terminal His-Tag / Data size: 762.3 EMPIAR-10496 (タイトル: MscS Nanodisc with N-terminal His-Tag / Data size: 762.3 Data #1: MscS Nanodisc with N-terminal His-Tag [micrographs - multiframe]) |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
| #1: タンパク質 | 分子量: 33094.258 Da / 分子数: 7 / 由来タイプ: 組換発現 由来: (組換発現)  株: K12 / 遺伝子: mscS, yggB, b2924, JW2891 / 発現宿主:  #2: 化合物 | ChemComp-POV / ( #3: 化合物 | ChemComp-R16 / 研究の焦点であるリガンドがあるか | N | Has protein modification | N | |
|---|
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: Mechanosensitive Channel of Small Conductance / タイプ: COMPLEX / Entity ID: #1 / 由来: RECOMBINANT |
|---|---|
| 分子量 | 単位: KILODALTONS/NANOMETER / 実験値: NO |
| 由来(天然) | 生物種:  |
| 由来(組換発現) | 生物種:  |
| 緩衝液 | pH: 7.4 |
| 試料 | 濃度: 2 mg/ml / 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES |
| 試料支持 | グリッドの材料: COPPER / グリッドのサイズ: 200 divisions/in. / グリッドのタイプ: Quantifoil R2/2 |
| 急速凍結 | 装置: FEI VITROBOT MARK IV / 凍結剤: ETHANE / 湿度: 100 % / 凍結前の試料温度: 295 K 詳細: 22C. Blot Force 3 for 3 seconds. Double application with a blotting between applications. |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD |
| 撮影 | 電子線照射量: 50 e/Å2 / 検出モード: COUNTING フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) |
| 画像スキャン | 動画フレーム数/画像: 50 |
- 解析
解析
| ソフトウェア | 名称: PHENIX / バージョン: 1.15.2_3472: / 分類: 精密化 | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| EMソフトウェア |
| ||||||||||||||||||||||||
| CTF補正 | タイプ: NONE | ||||||||||||||||||||||||
| 対称性 | 点対称性: C7 (7回回転対称) | ||||||||||||||||||||||||
| 3次元再構成 | 解像度: 3.1 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 372870 / 対称性のタイプ: POINT | ||||||||||||||||||||||||
| 原子モデル構築 | プロトコル: FLEXIBLE FIT / 空間: REAL | ||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー






 PDBj
PDBj