| 登録情報 | データベース: PDB / ID: 6eav
|
|---|
| タイトル | Crystallographic structure of the cyclic heptapeptide derived from the BTCI inhibitor bound to beta-trypsin in space group P 4(1) 2(1) 2 |
|---|
 要素 要素 | - CYS-THR-LYS
- Cationic trypsin
|
|---|
 キーワード キーワード | hydrolase/hydrolase inhibitor / Inhibitor Complex / BTCI / HYDROLASE / hydrolase-hydrolase inhibitor complex |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
trypsin / serpin family protein binding / serine protease inhibitor complex / digestion / serine-type endopeptidase inhibitor activity / endopeptidase activity / serine-type endopeptidase activity / proteolysis / extracellular space / extracellular region / metal ion binding類似検索 - 分子機能 Bowman-Birk serine protease inhibitors family signature. / Proteinase inhibitor I12, Bowman-Birk / Bowman-Birk type proteinase inhibitor / Bowman-Birk type proteinase inhibitor / : / Serine proteases, trypsin family, histidine active site / Serine proteases, trypsin family, serine active site / Serine proteases, trypsin family, histidine active site. / Peptidase S1A, chymotrypsin family / Serine proteases, trypsin family, serine active site. ...Bowman-Birk serine protease inhibitors family signature. / Proteinase inhibitor I12, Bowman-Birk / Bowman-Birk type proteinase inhibitor / Bowman-Birk type proteinase inhibitor / : / Serine proteases, trypsin family, histidine active site / Serine proteases, trypsin family, serine active site / Serine proteases, trypsin family, histidine active site. / Peptidase S1A, chymotrypsin family / Serine proteases, trypsin family, serine active site. / Serine proteases, trypsin domain profile. / Trypsin-like serine protease / Serine proteases, trypsin domain / Trypsin / Trypsin-like serine proteases / Thrombin, subunit H / Peptidase S1, PA clan, chymotrypsin-like fold / Peptidase S1, PA clan / Beta Barrel / Mainly Beta類似検索 - ドメイン・相同性 Serine protease 1 / Bowman-Birk type seed trypsin and chymotrypsin inhibitor類似検索 - 構成要素 |
|---|
| 生物種 |   Bos taurus (ウシ) Bos taurus (ウシ)
 Vigna unguiculata (マメ科) Vigna unguiculata (マメ科) |
|---|
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 1.391 Å 分子置換 / 解像度: 1.391 Å |
|---|
 データ登録者 データ登録者 | Fernandes, J.C. / Valadares, N.F. / Freitas, S.M. / Barbosa, J.A.R.G. |
|---|
| 資金援助 |  ブラジル, 1件 ブラジル, 1件 | 組織 | 認可番号 | 国 |
|---|
| Brazilian National Council for Scientific and Technological Development (CNPq) | 309054/2014-1 |  ブラジル ブラジル |
|
|---|
 引用 引用 |  ジャーナル: To Be Published ジャーナル: To Be Published
タイトル: Crystallographic structure of the cyclic heptapeptide derived from the BTCI inhibitor bound to beta-trypsin in space group P 4(1) 2(1) 2
著者: Fenandes, J.F. / Valadares, N.F. / Freitas, S.M. / Barbosa, J.A.R.G. |
|---|
| 履歴 | | 登録 | 2018年8月3日 | 登録サイト: RCSB / 処理サイト: RCSB |
|---|
| 改定 1.0 | 2019年8月7日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2020年1月8日 | Group: Author supporting evidence / カテゴリ: pdbx_audit_support / Item: _pdbx_audit_support.funding_organization |
|---|
| 改定 1.2 | 2023年10月11日 | Group: Data collection / Database references / Refinement description
カテゴリ: chem_comp_atom / chem_comp_bond ...chem_comp_atom / chem_comp_bond / database_2 / pdbx_initial_refinement_model
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession |
|---|
| 改定 1.3 | 2024年11月6日 | Group: Structure summary
カテゴリ: pdbx_entry_details / pdbx_modification_feature |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報
 Vigna unguiculata (マメ科)
Vigna unguiculata (マメ科) X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  分子置換 / 解像度: 1.391 Å
分子置換 / 解像度: 1.391 Å  データ登録者
データ登録者 ブラジル, 1件
ブラジル, 1件  引用
引用 ジャーナル: To Be Published
ジャーナル: To Be Published 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 6eav.cif.gz
6eav.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb6eav.ent.gz
pdb6eav.ent.gz PDB形式
PDB形式 6eav.json.gz
6eav.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 6eav_validation.pdf.gz
6eav_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 6eav_full_validation.pdf.gz
6eav_full_validation.pdf.gz 6eav_validation.xml.gz
6eav_validation.xml.gz 6eav_validation.cif.gz
6eav_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/ea/6eav
https://data.pdbj.org/pub/pdb/validation_reports/ea/6eav ftp://data.pdbj.org/pub/pdb/validation_reports/ea/6eav
ftp://data.pdbj.org/pub/pdb/validation_reports/ea/6eav
 リンク
リンク 集合体
集合体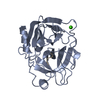
 要素
要素
 Vigna unguiculata (マメ科) / 参照: UniProt: P17734*PLUS
Vigna unguiculata (マメ科) / 参照: UniProt: P17734*PLUS X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  LNLS
LNLS  / ビームライン: W01B-MX2 / 波長: 1.30004 Å
/ ビームライン: W01B-MX2 / 波長: 1.30004 Å 解析
解析 分子置換
分子置換 ムービー
ムービー コントローラー
コントローラー

























 PDBj
PDBj




