| 登録情報 | データベース: PDB / ID: 6dhn
|
|---|
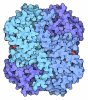
| タイトル | Bovine glutamate dehydrogenase complexed with Eu3+ |
|---|
 要素 要素 | Glutamate dehydrogenase 1, mitochondrial |
|---|
 キーワード キーワード | OXIDOREDUCTASE / Europium / glutamate / dehydrogenase |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
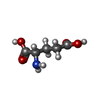
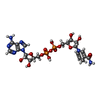
Glutamate and glutamine metabolism / Transcriptional activation of mitochondrial biogenesis / glutamate dehydrogenase [NAD(P)+] activity / tricarboxylic acid metabolic process / glutamate dehydrogenase [NAD(P)+] / glutamate dehydrogenase (NAD+) activity / glutamate dehydrogenase (NADP+) activity / L-glutamate catabolic process / glutamine metabolic process / Mitochondrial protein degradation ...Glutamate and glutamine metabolism / Transcriptional activation of mitochondrial biogenesis / glutamate dehydrogenase [NAD(P)+] activity / tricarboxylic acid metabolic process / glutamate dehydrogenase [NAD(P)+] / glutamate dehydrogenase (NAD+) activity / glutamate dehydrogenase (NADP+) activity / L-glutamate catabolic process / glutamine metabolic process / Mitochondrial protein degradation / positive regulation of insulin secretion / mitochondrial inner membrane / mitochondrial matrix / nucleotide binding / GTP binding / endoplasmic reticulum / mitochondrion / ATP binding / identical protein binding類似検索 - 分子機能 Helix Hairpins - #140 / Leucine Dehydrogenase, chain A, domain 1 / NAD(P) binding domain of glutamate dehydrogenase / Leu/Phe/Val dehydrogenases active site / Glu / Leu / Phe / Val dehydrogenases active site. / Glutamate/phenylalanine/leucine/valine dehydrogenase / Glutamate/phenylalanine/leucine/valine dehydrogenase, dimerisation domain / Glu/Leu/Phe/Val dehydrogenase, dimerisation domain / Glutamate/Leucine/Phenylalanine/Valine dehydrogenase / Glutamate/phenylalanine/leucine/valine dehydrogenase, C-terminal ...Helix Hairpins - #140 / Leucine Dehydrogenase, chain A, domain 1 / NAD(P) binding domain of glutamate dehydrogenase / Leu/Phe/Val dehydrogenases active site / Glu / Leu / Phe / Val dehydrogenases active site. / Glutamate/phenylalanine/leucine/valine dehydrogenase / Glutamate/phenylalanine/leucine/valine dehydrogenase, dimerisation domain / Glu/Leu/Phe/Val dehydrogenase, dimerisation domain / Glutamate/Leucine/Phenylalanine/Valine dehydrogenase / Glutamate/phenylalanine/leucine/valine dehydrogenase, C-terminal / Glutamate/Leucine/Phenylalanine/Valine dehydrogenase / Aminoacid dehydrogenase-like, N-terminal domain superfamily / Helix Hairpins / NAD(P)-binding Rossmann-like Domain / NAD(P)-binding domain superfamily / Rossmann fold / Orthogonal Bundle / 3-Layer(aba) Sandwich / Mainly Alpha / Alpha Beta類似検索 - ドメイン・相同性 GLUTAMIC ACID / GUANOSINE-5'-TRIPHOSPHATE / 1,4-DIHYDRONICOTINAMIDE ADENINE DINUCLEOTIDE / Glutamate dehydrogenase 1, mitochondrial / Glutamate dehydrogenase 1, mitochondrial類似検索 - 構成要素 |
|---|
| 生物種 |   Bos taurus (ウシ) Bos taurus (ウシ) |
|---|
| 手法 |  X線回折 / X線回折 /  分子置換 / 解像度: 3.3 Å 分子置換 / 解像度: 3.3 Å |
|---|
 データ登録者 データ登録者 | Smith, T.J. |
|---|
 引用 引用 |  ジャーナル: FEBS J. / 年: 2011 ジャーナル: FEBS J. / 年: 2011
タイトル: A novel mechanism of V-type zinc inhibition of glutamate dehydrogenase results from disruption of subunit interactions necessary for efficient catalysis.
著者: Bailey, J. / Powell, L. / Sinanan, L. / Neal, J. / Li, M. / Smith, T. / Bell, E. |
|---|
| 履歴 | | 登録 | 2018年5月20日 | 登録サイト: RCSB / 処理サイト: RCSB |
|---|
| 置き換え | 2018年7月25日 | ID: 3MVO |
|---|
| 改定 1.0 | 2018年7月25日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2024年12月25日 | Group: Advisory / Data collection ...Advisory / Data collection / Database references / Derived calculations / Structure summary
カテゴリ: chem_comp_atom / chem_comp_bond ...chem_comp_atom / chem_comp_bond / database_2 / pdbx_entry_details / pdbx_unobs_or_zero_occ_atoms / pdbx_validate_close_contact / struct_conn
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報
 X線回折 /
X線回折 /  分子置換 / 解像度: 3.3 Å
分子置換 / 解像度: 3.3 Å  データ登録者
データ登録者 引用
引用 ジャーナル: FEBS J. / 年: 2011
ジャーナル: FEBS J. / 年: 2011 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 6dhn.cif.gz
6dhn.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb6dhn.ent.gz
pdb6dhn.ent.gz PDB形式
PDB形式 6dhn.json.gz
6dhn.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 6dhn_validation.pdf.gz
6dhn_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 6dhn_full_validation.pdf.gz
6dhn_full_validation.pdf.gz 6dhn_validation.xml.gz
6dhn_validation.xml.gz 6dhn_validation.cif.gz
6dhn_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/dh/6dhn
https://data.pdbj.org/pub/pdb/validation_reports/dh/6dhn ftp://data.pdbj.org/pub/pdb/validation_reports/dh/6dhn
ftp://data.pdbj.org/pub/pdb/validation_reports/dh/6dhn リンク
リンク 集合体
集合体
 要素
要素
 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 回転陽極 / タイプ: BRUKER AXS MICROSTAR / 波長: 1.5418 Å
回転陽極 / タイプ: BRUKER AXS MICROSTAR / 波長: 1.5418 Å 解析
解析 分子置換 / 解像度: 3.3→43.888 Å / SU ML: 0.49 / 交差検証法: FREE R-VALUE / σ(F): 1 / 位相誤差: 29.48
分子置換 / 解像度: 3.3→43.888 Å / SU ML: 0.49 / 交差検証法: FREE R-VALUE / σ(F): 1 / 位相誤差: 29.48  ムービー
ムービー コントローラー
コントローラー













 PDBj
PDBj