| Software | | Name | Version | Classification |
|---|
| XSCALE | | data scaling| PHENIX | (1.12rc0_2798: ???)refinement| PDB_EXTRACT | 3.22 | data extraction| XDS | | data reduction| MOLREP | | phasing | | | | | |
|
|---|
| Refinement | Method to determine structure:  MOLECULAR REPLACEMENT MOLECULAR REPLACEMENT
Starting model: 4i1u
Resolution: 2→44.171 Å / SU ML: 0.17 / Cross valid method: FREE R-VALUE / σ(F): 1.34 / Phase error: 18.92
| Rfactor | Num. reflection | % reflection |
|---|
| Rfree | 0.2083 | 1948 | 5.38 % |
|---|
| Rwork | 0.1665 | - | - |
|---|
| obs | 0.1687 | 36241 | 99.95 % |
|---|
|
|---|
| Solvent computation | Shrinkage radii: 0.9 Å / VDW probe radii: 1.11 Å |
|---|
| Displacement parameters | Biso max: 87.17 Å2 / Biso mean: 33.625 Å2 / Biso min: 12.65 Å2 |
|---|
| Refinement step | Cycle: final / Resolution: 2→44.171 Å
| Protein | Nucleic acid | Ligand | Solvent | Total |
|---|
| Num. atoms | 3002 | 0 | 118 | 305 | 3425 |
|---|
| Biso mean | - | - | 60.87 | 41.38 | - |
|---|
| Num. residues | - | - | - | - | 403 |
|---|
|
|---|
| Refine LS restraints | | Refine-ID | Type | Dev ideal | Number |
|---|
| X-RAY DIFFRACTION | f_bond_d| 0.006 | 3214 | | X-RAY DIFFRACTION | f_angle_d| 0.759 | 4401 | | X-RAY DIFFRACTION | f_chiral_restr| 0.049 | 517 | | X-RAY DIFFRACTION | f_plane_restr| 0.004 | 582 | | X-RAY DIFFRACTION | f_dihedral_angle_d| 14.897 | 1910 | | | | | |
|
|---|
| LS refinement shell | Refine-ID: X-RAY DIFFRACTION / Rfactor Rfree error: 0 / Total num. of bins used: 14 / % reflection obs: 100 % | Resolution (Å) | Rfactor Rfree | Num. reflection Rfree | Rfactor Rwork | Num. reflection Rwork | Num. reflection all |
|---|
| 2-2.05 | 0.2679 | 112 | 0.1987 | 2406 | 2518 | | 2.05-2.1054 | 0.2066 | 151 | 0.1739 | 2380 | 2531 | | 2.1054-2.1674 | 0.2353 | 149 | 0.169 | 2401 | 2550 | | 2.1674-2.2374 | 0.2197 | 146 | 0.1619 | 2374 | 2520 | | 2.2374-2.3173 | 0.2262 | 133 | 0.1655 | 2440 | 2573 | | 2.3173-2.4101 | 0.2083 | 128 | 0.1615 | 2429 | 2557 | | 2.4101-2.5198 | 0.1918 | 136 | 0.1672 | 2439 | 2575 | | 2.5198-2.6526 | 0.2503 | 132 | 0.1733 | 2443 | 2575 | | 2.6526-2.8188 | 0.2556 | 137 | 0.1799 | 2413 | 2550 | | 2.8188-3.0364 | 0.2727 | 147 | 0.176 | 2461 | 2608 | | 3.0364-3.3418 | 0.2001 | 137 | 0.1752 | 2469 | 2606 | | 3.3418-3.8252 | 0.1833 | 174 | 0.158 | 2422 | 2596 | | 3.8252-4.8183 | 0.1805 | 140 | 0.1419 | 2530 | 2670 | | 4.8183-44.1822 | 0.1834 | 126 | 0.1764 | 2686 | 2812 |
|
|---|
| Refinement TLS params. | Method: refined / Refine-ID: X-RAY DIFFRACTION | ID | L11 (°2) | L12 (°2) | L13 (°2) | L22 (°2) | L23 (°2) | L33 (°2) | S11 (Å °) | S12 (Å °) | S13 (Å °) | S21 (Å °) | S22 (Å °) | S23 (Å °) | S31 (Å °) | S32 (Å °) | S33 (Å °) | T11 (Å2) | T12 (Å2) | T13 (Å2) | T22 (Å2) | T23 (Å2) | T33 (Å2) | Origin x (Å) | Origin y (Å) | Origin z (Å) |
|---|
| 1 | 4.8073 | 0.6844 | 1.3228 | 4.1184 | 0.0857 | 4.8066 | -0.1381 | 0.1187 | 0.3229 | -0.0923 | 0.0009 | 0.1301 | -0.1405 | 0.1242 | 0.1236 | 0.2231 | 0.0435 | -0.0452 | 0.1683 | 0.0075 | 0.1711 | -26.2891 | 2.9522 | -32.907 | | 2 | 2.5473 | -2.5197 | 2.0658 | 2.6439 | -1.7648 | 2.0346 | 0.0715 | -0.4301 | -0.1206 | 0.3806 | -0.0468 | 0.1138 | -0.1717 | -0.4145 | -0.1089 | 0.2432 | -0.0138 | -0.0106 | 0.2291 | 0.0203 | 0.1626 | -33.858 | 8.5328 | -42.3192 | | 3 | 5.4194 | -1.5813 | -2.2092 | 2.6286 | -1.2489 | 3.7254 | -0.2645 | 0.4003 | -0.6422 | -0.0439 | -0.0574 | 0.5206 | 0.5946 | -0.4795 | 0.2899 | 0.2619 | -0.0542 | 0.0205 | 0.2258 | -0.0783 | 0.262 | -45.6032 | 5.6882 | -55.608 | | 4 | 6.8908 | 3.6189 | 5.1459 | 5.093 | 2.8377 | 7.4956 | -0.047 | 0.321 | -0.1832 | -0.0688 | 0.029 | -0.2202 | -0.0601 | 0.5245 | 0.031 | 0.1901 | 0.0661 | 0.0105 | 0.1892 | 0.025 | 0.1614 | -30.4488 | 8.4116 | -53.2631 | | 5 | 2.5729 | 0.6834 | 0.1678 | 3.4184 | -2.6038 | 4.0675 | -0.2499 | 0.5366 | -0.0208 | -0.6168 | 0.187 | 0.1141 | 0.2121 | 0.2334 | 0.0719 | 0.2943 | -0.003 | -0.0365 | 0.2991 | -0.0164 | 0.1859 | -24.2663 | -0.4514 | -39.4251 | | 6 | 2.3195 | -0.1938 | 1.6054 | 7.698 | 0.7059 | 7.2957 | 0.3131 | -0.4514 | 0.2853 | 0.0215 | 0.0757 | 0.874 | 0.1639 | -1.0102 | -0.3616 | 0.2564 | -0.0159 | -0.0393 | 0.3848 | 0.0285 | 0.3868 | -41.5743 | -9.4352 | -30.7546 | | 7 | 6.6942 | 2.3484 | 1.8894 | 3.6388 | 0.0516 | 2.9363 | 0.0392 | 0.3112 | -0.6229 | -0.498 | 0.1395 | 0.1973 | 0.6455 | -0.2123 | -0.1467 | 0.4616 | -0.0001 | -0.0956 | 0.2346 | -0.0459 | 0.3155 | -33.4299 | -11.175 | -36.2838 | | 8 | 2.6752 | 2.8409 | 1.0533 | 5.7293 | -0.2057 | 4.8884 | -0.0846 | -0.0654 | -0.0611 | 0.1892 | -0.0365 | -0.3291 | 0.1662 | 0.393 | 0.2272 | 0.2566 | 0.0403 | -0.0499 | 0.2961 | -0.0074 | 0.2178 | -17.2252 | 1.6004 | -27.4959 | | 9 | 2.1138 | -0.275 | -1.0789 | 2.3988 | 1.4096 | 4.3383 | -0.1146 | -0.0061 | -0.3133 | 0.0529 | -0.0941 | 0.4238 | 0.3064 | -0.1489 | 0.1884 | 0.1684 | -0.0583 | -0.0099 | 0.1035 | 0.0071 | 0.1728 | -27.0084 | 10.5498 | -6.8288 | | 10 | 1.7411 | -0.5626 | 0.578 | 3.8448 | -3.4479 | 3.1611 | -0.1101 | -0.125 | -0.0807 | 0.1359 | 0.1082 | -0.1622 | -0.1511 | -0.0526 | 0.0056 | 0.2046 | -0.0375 | -0.031 | 0.1623 | -0.0246 | 0.1817 | -24.8397 | -4.3331 | 9.4937 | | 11 | 3.782 | 3.6752 | 2.5993 | 3.6996 | 2.5127 | 2.3596 | -0.29 | -0.8231 | 1.0255 | 0.5361 | -0.013 | 0.0703 | -0.2896 | -0.1913 | 0.2612 | 0.3953 | -0.0385 | -0.1274 | 0.3585 | -0.1075 | 0.3341 | -25.8047 | -1.3231 | 21.7179 | | 12 | 1.9759 | -0.2583 | 2.3111 | 1.0894 | -0.1776 | 8.2388 | -0.0659 | 0.0561 | 0.1359 | 0.1037 | -0.0118 | -0.3051 | -0.278 | 0.8134 | 0.0234 | 0.1963 | -0.0784 | -0.038 | 0.1927 | 0.0315 | 0.2769 | -16.5874 | -2.5407 | 7.15 | | 13 | 1.7512 | -1.9014 | -1.8692 | 4.0838 | 1.3794 | 2.4619 | -0.1444 | -0.2985 | 0.1615 | 0.435 | 0.1857 | -0.2456 | 0.2681 | 0.3718 | -0.0095 | 0.2189 | -0.0344 | -0.0449 | 0.2058 | -0.0094 | 0.1735 | -20.0866 | 11.3224 | -3.5328 | | 14 | 4.2275 | -0.8801 | -3.7699 | 0.9425 | 0.1893 | 5.3068 | -0.1385 | -0.1278 | -0.2072 | 0.0441 | 0.0951 | -0.0622 | 0.1613 | -0.0208 | 0.0289 | 0.162 | -0.0395 | -0.0089 | 0.1167 | -0.0041 | 0.1358 | -28.9055 | 22.0865 | 8.2425 | | 15 | 2.8057 | -1.8858 | -1.3263 | 3.2755 | 2.4212 | 5.1026 | 0.0149 | 0.2145 | -0.1062 | -0.094 | -0.0595 | 0.1638 | -0.0024 | 0.0943 | 0.0222 | 0.1759 | -0.0696 | -0.0058 | 0.129 | 0.0113 | 0.1535 | -23.5995 | 15.357 | -14 |
|
|---|
| Refinement TLS group | | ID | Refine-ID | Refine TLS-ID | Selection details | Auth asym-ID | Auth seq-ID |
|---|
| 1 | X-RAY DIFFRACTION | 1 | chain 'A' and (resid 1 through 27 )A| 1 - 27 | | 2 | X-RAY DIFFRACTION | 2 | chain 'A' and (resid 28 through 40 )A| 28 - 40 | | 3 | X-RAY DIFFRACTION | 3 | chain 'A' and (resid 41 through 77 )A| 41 - 77 | | 4 | X-RAY DIFFRACTION | 4 | chain 'A' and (resid 78 through 102 )A| 78 - 102 | | 5 | X-RAY DIFFRACTION | 5 | chain 'A' and (resid 103 through 133 )A| 103 - 133 | | 6 | X-RAY DIFFRACTION | 6 | chain 'A' and (resid 134 through 145 )A| 134 - 145 | | 7 | X-RAY DIFFRACTION | 7 | chain 'A' and (resid 146 through 178 )A| 146 - 178 | | 8 | X-RAY DIFFRACTION | 8 | chain 'A' and (resid 179 through 200 )A| 179 - 200 | | 9 | X-RAY DIFFRACTION | 9 | chain 'B' and (resid 1 through 27 )B| 1 - 27 | | 10 | X-RAY DIFFRACTION | 10 | chain 'B' and (resid 28 through 54 )B| 28 - 54 | | 11 | X-RAY DIFFRACTION | 11 | chain 'B' and (resid 55 through 77 )B| 55 - 77 | | 12 | X-RAY DIFFRACTION | 12 | chain 'B' and (resid 78 through 102 )B| 78 - 102 | | 13 | X-RAY DIFFRACTION | 13 | chain 'B' and (resid 103 through 133 )| B | | | | | | | | | | | | | | | | | | | | | | | | | |
|
|---|
 Yorodumi
Yorodumi Open data
Open data Basic information
Basic information Components
Components Keywords
Keywords Function and homology information
Function and homology information
 X-RAY DIFFRACTION /
X-RAY DIFFRACTION /  SYNCHROTRON /
SYNCHROTRON /  MOLECULAR REPLACEMENT / Resolution: 2 Å
MOLECULAR REPLACEMENT / Resolution: 2 Å  Authors
Authors Citation
Citation Journal: TO BE PUBLISHED
Journal: TO BE PUBLISHED Structure visualization
Structure visualization Molmil
Molmil Jmol/JSmol
Jmol/JSmol Downloads & links
Downloads & links Download
Download 6ari.cif.gz
6ari.cif.gz PDBx/mmCIF format
PDBx/mmCIF format pdb6ari.ent.gz
pdb6ari.ent.gz PDB format
PDB format 6ari.json.gz
6ari.json.gz PDBx/mmJSON format
PDBx/mmJSON format Other downloads
Other downloads https://data.pdbj.org/pub/pdb/validation_reports/ar/6ari
https://data.pdbj.org/pub/pdb/validation_reports/ar/6ari ftp://data.pdbj.org/pub/pdb/validation_reports/ar/6ari
ftp://data.pdbj.org/pub/pdb/validation_reports/ar/6ari
 Links
Links Assembly
Assembly

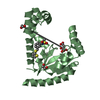
 Components
Components

 X-RAY DIFFRACTION / Number of used crystals: 1
X-RAY DIFFRACTION / Number of used crystals: 1  Sample preparation
Sample preparation SYNCHROTRON / Site:
SYNCHROTRON / Site:  APS
APS  / Beamline: 21-ID-F / Wavelength: 0.97872 Å
/ Beamline: 21-ID-F / Wavelength: 0.97872 Å Processing
Processing MOLECULAR REPLACEMENT
MOLECULAR REPLACEMENT Movie
Movie Controller
Controller









 PDBj
PDBj





