| 登録情報 | データベース: PDB / ID: 5v6f
|
|---|
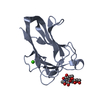
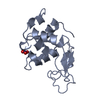
| タイトル | Crystal Structure of the Second beta-Prism Domain of RbmC from V. cholerae bound to Mannotriose |
|---|
 要素 要素 | Hemolysin-related protein |
|---|
 キーワード キーワード | SUGAR BINDING PROTEIN / lectin / beta-prism / glycan-binding domain / mannotriose |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
Metalloprotease StcE, C-terminal / Beta/Gamma crystallin / Hemolysin, beta-prism lectin / Beta-prism lectin / FG-GAP-like repeat / Jacalin-like lectin domain / Aligned Prism / Vitelline Membrane Outer Layer Protein I, subunit A / Jacalin-like lectin domain superfamily / FG-GAP repeat ...Metalloprotease StcE, C-terminal / Beta/Gamma crystallin / Hemolysin, beta-prism lectin / Beta-prism lectin / FG-GAP-like repeat / Jacalin-like lectin domain / Aligned Prism / Vitelline Membrane Outer Layer Protein I, subunit A / Jacalin-like lectin domain superfamily / FG-GAP repeat / Integrin alpha, N-terminal / EF-Hand 1, calcium-binding site / EF-hand calcium-binding domain. / Mainly Beta類似検索 - ドメイン・相同性 |
|---|
| 生物種 |  Vibrio cholerae serotype O1 (コレラ菌) Vibrio cholerae serotype O1 (コレラ菌) |
|---|
| 手法 |  X線回折 / X線回折 /  分子置換 / 解像度: 1.5 Å 分子置換 / 解像度: 1.5 Å |
|---|
| Model details | apo form |
|---|
 データ登録者 データ登録者 | De, S. / Kaus, K. / Sinclair, S. / Case, B.C. / Olson, R. |
|---|
| 資金援助 |  米国, 1件 米国, 1件 | 組織 | 認可番号 | 国 |
|---|
| National Institutes of Health/National Institute Of Allergy and Infectious Diseases (NIH/NIAID) | R15 AI101977 |  米国 米国 |
|
|---|
 引用 引用 |  ジャーナル: PLoS Pathog. / 年: 2018 ジャーナル: PLoS Pathog. / 年: 2018
タイトル: Structural basis of mammalian glycan targeting by Vibrio cholerae cytolysin and biofilm proteins.
著者: De, S. / Kaus, K. / Sinclair, S. / Case, B.C. / Olson, R. |
|---|
| 履歴 | | 登録 | 2017年3月16日 | 登録サイト: RCSB / 処理サイト: RCSB |
|---|
| 改定 1.0 | 2018年1月17日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2018年2月28日 | Group: Database references / カテゴリ: citation
Item: _citation.country / _citation.journal_abbrev ..._citation.country / _citation.journal_abbrev / _citation.journal_id_CSD / _citation.journal_id_ISSN / _citation.journal_volume / _citation.page_first / _citation.page_last / _citation.pdbx_database_id_DOI / _citation.pdbx_database_id_PubMed / _citation.title / _citation.year |
|---|
| 改定 1.2 | 2019年12月11日 | Group: Author supporting evidence / カテゴリ: pdbx_audit_support / Item: _pdbx_audit_support.funding_organization |
|---|
| 改定 2.0 | 2020年7月29日 | Group: Atomic model / Data collection ...Atomic model / Data collection / Derived calculations / Structure summary
カテゴリ: atom_site / chem_comp ...atom_site / chem_comp / entity / pdbx_branch_scheme / pdbx_chem_comp_identifier / pdbx_entity_branch / pdbx_entity_branch_descriptor / pdbx_entity_branch_link / pdbx_entity_branch_list / pdbx_entity_nonpoly / pdbx_nonpoly_scheme / pdbx_struct_assembly_gen / struct_asym / struct_conn / struct_site / struct_site_gen
Item: _atom_site.B_iso_or_equiv / _atom_site.Cartn_x ..._atom_site.B_iso_or_equiv / _atom_site.Cartn_x / _atom_site.Cartn_y / _atom_site.Cartn_z / _atom_site.auth_asym_id / _atom_site.auth_atom_id / _atom_site.auth_comp_id / _atom_site.auth_seq_id / _atom_site.label_asym_id / _atom_site.label_atom_id / _atom_site.label_comp_id / _atom_site.label_entity_id / _atom_site.type_symbol / _chem_comp.name / _chem_comp.type / _pdbx_struct_assembly_gen.asym_id_list / _struct_conn.ptnr1_auth_asym_id / _struct_conn.ptnr1_auth_comp_id / _struct_conn.ptnr1_auth_seq_id / _struct_conn.ptnr1_label_asym_id / _struct_conn.ptnr1_label_atom_id / _struct_conn.ptnr1_label_comp_id / _struct_conn.ptnr2_auth_asym_id / _struct_conn.ptnr2_auth_comp_id / _struct_conn.ptnr2_auth_seq_id / _struct_conn.ptnr2_label_asym_id / _struct_conn.ptnr2_label_atom_id / _struct_conn.ptnr2_label_comp_id
解説: Carbohydrate remediation / Provider: repository / タイプ: Remediation |
|---|
| 改定 2.1 | 2023年10月4日 | Group: Data collection / Database references ...Data collection / Database references / Derived calculations / Refinement description / Structure summary
カテゴリ: chem_comp / chem_comp_atom ...chem_comp / chem_comp_atom / chem_comp_bond / database_2 / pdbx_initial_refinement_model / struct_conn
Item: _chem_comp.pdbx_synonyms / _database_2.pdbx_DOI ..._chem_comp.pdbx_synonyms / _database_2.pdbx_DOI / _database_2.pdbx_database_accession / _struct_conn.pdbx_leaving_atom_flag |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Vibrio cholerae serotype O1 (コレラ菌)
Vibrio cholerae serotype O1 (コレラ菌) X線回折 /
X線回折 /  分子置換 / 解像度: 1.5 Å
分子置換 / 解像度: 1.5 Å  データ登録者
データ登録者 米国, 1件
米国, 1件  引用
引用 ジャーナル: PLoS Pathog. / 年: 2018
ジャーナル: PLoS Pathog. / 年: 2018 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 5v6f.cif.gz
5v6f.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb5v6f.ent.gz
pdb5v6f.ent.gz PDB形式
PDB形式 5v6f.json.gz
5v6f.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 5v6f_validation.pdf.gz
5v6f_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 5v6f_full_validation.pdf.gz
5v6f_full_validation.pdf.gz 5v6f_validation.xml.gz
5v6f_validation.xml.gz 5v6f_validation.cif.gz
5v6f_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/v6/5v6f
https://data.pdbj.org/pub/pdb/validation_reports/v6/5v6f ftp://data.pdbj.org/pub/pdb/validation_reports/v6/5v6f
ftp://data.pdbj.org/pub/pdb/validation_reports/v6/5v6f リンク
リンク 集合体
集合体
 要素
要素 Vibrio cholerae serotype O1 (strain ATCC 39315 / El Tor Inaba N16961) (コレラ菌)
Vibrio cholerae serotype O1 (strain ATCC 39315 / El Tor Inaba N16961) (コレラ菌)
 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 分子置換
分子置換 解析
解析 分子置換
分子置換 ムービー
ムービー コントローラー
コントローラー














 PDBj
PDBj



