[English] 日本語
 Yorodumi
Yorodumi- PDB-5unu: Structure of rat neuronal nitric oxide synthase heme domain in co... -
+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 5unu | ||||||
|---|---|---|---|---|---|---|---|
| Title | Structure of rat neuronal nitric oxide synthase heme domain in complex with 3-[(2-amino-4-methylquinolin-7-yl)methoxy]-5-((methylamino)methyl)benzonitrile | ||||||
 Components Components | Nitric oxide synthase, brain | ||||||
 Keywords Keywords | OXIDOREDUCTASE/OXIDOREDUCTASE INHIBITOR / nitric / oxide / synthase / inhibitor / complex / heme / enzyme / OXIDOREDUCTASE-OXIDOREDUCTASE INHIBITOR complex | ||||||
| Function / homology |  Function and homology information Function and homology informationNitric oxide stimulates guanylate cyclase / negative regulation of hepatic stellate cell contraction / positive regulation of adenylate cyclase-activating adrenergic receptor signaling pathway / negative regulation of iron ion transmembrane transport / response to vitamin B3 / postsynaptic specialization, intracellular component / ROS and RNS production in phagocytes / azurophil granule / Ion homeostasis / synaptic signaling by nitric oxide ...Nitric oxide stimulates guanylate cyclase / negative regulation of hepatic stellate cell contraction / positive regulation of adenylate cyclase-activating adrenergic receptor signaling pathway / negative regulation of iron ion transmembrane transport / response to vitamin B3 / postsynaptic specialization, intracellular component / ROS and RNS production in phagocytes / azurophil granule / Ion homeostasis / synaptic signaling by nitric oxide / negative regulation of vasoconstriction / response to nitric oxide / positive regulation of adenylate cyclase-activating G protein-coupled receptor signaling pathway / response to vitamin E / negative regulation of cytosolic calcium ion concentration / positive regulation of sodium ion transmembrane transport / peptidyl-cysteine S-nitrosylase activity / positive regulation of the force of heart contraction / neuron projection terminus / cadmium ion binding / negative regulation of calcium ion transport / negative regulation of potassium ion transport / regulation of postsynaptic membrane potential / nitric oxide mediated signal transduction / nitric-oxide synthase (NADPH) / sodium channel regulator activity / regulation of neurogenesis / negative regulation of serotonin uptake / nitric-oxide synthase activity / xenobiotic catabolic process / L-arginine catabolic process / multicellular organismal response to stress / NADPH binding / striated muscle contraction / postsynaptic density, intracellular component / nitric oxide-cGMP-mediated signaling / negative regulation of blood pressure / regulation of sodium ion transport / response to hormone / nitric oxide metabolic process / behavioral response to cocaine / nitric oxide biosynthetic process / photoreceptor inner segment / cellular response to epinephrine stimulus / T-tubule / sarcoplasmic reticulum membrane / secretory granule / calyx of Held / positive regulation of long-term synaptic potentiation / response to activity / cell periphery / sarcoplasmic reticulum / response to nicotine / establishment of localization in cell / phosphoprotein binding / establishment of protein localization / female pregnancy / cellular response to mechanical stimulus / response to nutrient levels / negative regulation of insulin secretion / sarcolemma / caveola / response to peptide hormone / response to lead ion / response to estrogen / cellular response to growth factor stimulus / vasodilation / Z disc / calcium-dependent protein binding / FMN binding / NADP binding / flavin adenine dinucleotide binding / positive regulation of neuron apoptotic process / response to heat / ATPase binding / scaffold protein binding / response to lipopolysaccharide / nuclear membrane / dendritic spine / response to ethanol / negative regulation of neuron apoptotic process / perikaryon / RNA polymerase II-specific DNA-binding transcription factor binding / transmembrane transporter binding / cytoskeleton / response to hypoxia / mitochondrial outer membrane / calmodulin binding / postsynaptic density / membrane raft / negative regulation of cell population proliferation / heme binding / synapse / dendrite / negative regulation of apoptotic process / positive regulation of DNA-templated transcription / perinuclear region of cytoplasm / glutamatergic synapse / enzyme binding / positive regulation of transcription by RNA polymerase II Similarity search - Function | ||||||
| Biological species |  | ||||||
| Method |  X-RAY DIFFRACTION / X-RAY DIFFRACTION /  SYNCHROTRON / SYNCHROTRON /  FOURIER SYNTHESIS / Resolution: 2.05 Å FOURIER SYNTHESIS / Resolution: 2.05 Å | ||||||
 Authors Authors | Li, H. / Poulos, T.L. | ||||||
| Funding support |  United States, 1items United States, 1items
| ||||||
 Citation Citation |  Journal: J. Med. Chem. / Year: 2017 Journal: J. Med. Chem. / Year: 2017Title: Nitrile in the Hole: Discovery of a Small Auxiliary Pocket in Neuronal Nitric Oxide Synthase Leading to the Development of Potent and Selective 2-Aminoquinoline Inhibitors. Authors: Cinelli, M.A. / Li, H. / Chreifi, G. / Poulos, T.L. / Silverman, R.B. | ||||||
| History |
|
- Structure visualization
Structure visualization
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  5unu.cif.gz 5unu.cif.gz | 360.5 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb5unu.ent.gz pdb5unu.ent.gz | 292.4 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  5unu.json.gz 5unu.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/un/5unu https://data.pdbj.org/pub/pdb/validation_reports/un/5unu ftp://data.pdbj.org/pub/pdb/validation_reports/un/5unu ftp://data.pdbj.org/pub/pdb/validation_reports/un/5unu | HTTPS FTP |
|---|
-Related structure data
| Related structure data |  5unrC  5unsC  5untC  5unvC  5unwC  5unxC  5unyC  5unzC  5uo0C  5uo1C  5uo2C  5uo3C  5uo4C  5uo5C  5uo6C  5uo7C  5uo8C  5uo9C  5uoaC  5uobC  5uocC  5uodC  1om4S C: citing same article ( S: Starting model for refinement |
|---|---|
| Similar structure data |
- Links
Links
- Assembly
Assembly
| Deposited unit | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| Unit cell |
|
- Components
Components
-Protein , 1 types, 2 molecules AB
| #1: Protein | Mass: 48812.527 Da / Num. of mol.: 2 / Fragment: UNP residues 297-718 Source method: isolated from a genetically manipulated source Source: (gene. exp.)   |
|---|
-Non-polymers , 6 types, 262 molecules 


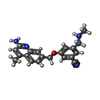







| #2: Chemical | | #3: Chemical | #4: Chemical | #5: Chemical | #6: Chemical | ChemComp-ZN / | #7: Water | ChemComp-HOH / | |
|---|
-Experimental details
-Experiment
| Experiment | Method:  X-RAY DIFFRACTION / Number of used crystals: 1 X-RAY DIFFRACTION / Number of used crystals: 1 |
|---|
- Sample preparation
Sample preparation
| Crystal | Density Matthews: 2.48 Å3/Da / Density % sol: 50.4 % / Description: brick |
|---|---|
| Crystal grow | Temperature: 277 K / Method: vapor diffusion, sitting drop / pH: 5.8 Details: 20-24% PEG3350, 0.1 M MES, 0.14-0.20 M ammonium acetate, 10% ethylene glycol, 30 uM SDS, 5 mM GSH |
-Data collection
| Diffraction | Mean temperature: 100 K |
|---|---|
| Diffraction source | Source:  SYNCHROTRON / Site: SYNCHROTRON / Site:  SSRL SSRL  / Beamline: BL14-1 / Wavelength: 0.979 Å / Beamline: BL14-1 / Wavelength: 0.979 Å |
| Detector | Type: MARMOSAIC 325 mm CCD / Detector: CCD / Date: Jul 8, 2015 / Details: mirrors |
| Radiation | Monochromator: double crystal Si(111) / Protocol: SINGLE WAVELENGTH / Monochromatic (M) / Laue (L): M / Scattering type: x-ray |
| Radiation wavelength | Wavelength: 0.979 Å / Relative weight: 1 |
| Reflection | Resolution: 2→50 Å / Num. obs: 65427 / % possible obs: 100 % / Observed criterion σ(I): -3 / Redundancy: 5.1 % / CC1/2: 0.996 / Rmerge(I) obs: 0.144 / Rsym value: 0.144 / Net I/σ(I): 6.4 |
| Reflection shell | Resolution: 2→2.08 Å / Redundancy: 5.1 % / Rmerge(I) obs: 2.241 / Mean I/σ(I) obs: 0.6 / Num. unique all: 4532 / CC1/2: 0.453 / % possible all: 100 |
- Processing
Processing
| Software |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Refinement | Method to determine structure:  FOURIER SYNTHESIS FOURIER SYNTHESISStarting model: PDB entry 1OM4 Resolution: 2.05→49.472 Å / SU ML: 0.34 / Cross valid method: FREE R-VALUE / σ(F): 1.33 / Phase error: 32.56
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solvent computation | Shrinkage radii: 0.9 Å / VDW probe radii: 1.11 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement step | Cycle: LAST / Resolution: 2.05→49.472 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine LS restraints |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS refinement shell |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS params. | Method: refined / Refine-ID: X-RAY DIFFRACTION
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS group |
|
 Movie
Movie Controller
Controller






















 PDBj
PDBj








