+ データを開く
データを開く
- 基本情報
基本情報
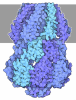
| 登録情報 | データベース: PDB / ID: 5lqw | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | yeast activated spliceosome | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード | SPLICING / activated spliceosome / spliceosome / pre-mRNA splicing | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報maintenance of RNA location / RES complex / U2-type post-mRNA release spliceosomal complex / cellular bud site selection / snoRNA splicing / post-mRNA release spliceosomal complex / generation of catalytic spliceosome for first transesterification step / cis assembly of pre-catalytic spliceosome / spliceosome conformational change to release U4 (or U4atac) and U1 (or U11) / U4/U6 snRNP ...maintenance of RNA location / RES complex / U2-type post-mRNA release spliceosomal complex / cellular bud site selection / snoRNA splicing / post-mRNA release spliceosomal complex / generation of catalytic spliceosome for first transesterification step / cis assembly of pre-catalytic spliceosome / spliceosome conformational change to release U4 (or U4atac) and U1 (or U11) / U4/U6 snRNP / 7-methylguanosine cap hypermethylation / pICln-Sm protein complex / U2-type catalytic step 1 spliceosome / pre-mRNA binding / snRNP binding / ATP-dependent activity, acting on RNA / small nuclear ribonucleoprotein complex / splicing factor binding / SMN-Sm protein complex / spliceosomal tri-snRNP complex / commitment complex / mRNA cis splicing, via spliceosome / U2-type prespliceosome assembly / U2-type spliceosomal complex / U2-type catalytic step 2 spliceosome / U2 snRNP / U1 snRNP / U4 snRNP / poly(U) RNA binding / U2-type prespliceosome / precatalytic spliceosome / generation of catalytic spliceosome for second transesterification step / Formation of TC-NER Pre-Incision Complex / mRNA 5'-splice site recognition / spliceosomal complex assembly / mRNA 3'-splice site recognition / Gap-filling DNA repair synthesis and ligation in TC-NER / DNA replication origin binding / spliceosomal tri-snRNP complex assembly / Prp19 complex / Dual incision in TC-NER / U5 snRNA binding / DNA replication initiation / U5 snRNP / U2 snRNA binding / U6 snRNA binding / pre-mRNA intronic binding / spliceosomal snRNP assembly / mRNA export from nucleus / U1 snRNA binding / U4/U6 x U5 tri-snRNP complex / positive regulation of cell cycle / catalytic step 2 spliceosome / positive regulation of RNA splicing / spliceosomal complex / helicase activity / mRNA splicing, via spliceosome / metallopeptidase activity / nucleic acid binding / RNA helicase activity / RNA helicase / response to xenobiotic stimulus / GTPase activity / mRNA binding / chromatin binding / chromatin / GTP binding / ATP hydrolysis activity / DNA binding / RNA binding / zinc ion binding / ATP binding / identical protein binding / nucleus / cytosol / cytoplasm 類似検索 - 分子機能 | ||||||
| 生物種 |  | ||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 5.8 Å | ||||||
 データ登録者 データ登録者 | Rauhut, R. / Luehrmann, R. | ||||||
| 資金援助 |  ドイツ, 1件 ドイツ, 1件
| ||||||
 引用 引用 |  ジャーナル: Science / 年: 2016 ジャーナル: Science / 年: 2016タイトル: Molecular architecture of the Saccharomyces cerevisiae activated spliceosome. 著者: Reinhard Rauhut / Patrizia Fabrizio / Olexandr Dybkov / Klaus Hartmuth / Vladimir Pena / Ashwin Chari / Vinay Kumar / Chung-Tien Lee / Henning Urlaub / Berthold Kastner / Holger Stark / Reinhard Lührmann /  要旨: The activated spliceosome (B) is in a catalytically inactive state and is remodeled into a catalytically active machine by the RNA helicase Prp2, but the mechanism is unclear. Here, we describe a 3D ...The activated spliceosome (B) is in a catalytically inactive state and is remodeled into a catalytically active machine by the RNA helicase Prp2, but the mechanism is unclear. Here, we describe a 3D electron cryomicroscopy structure of the Saccharomyces cerevisiae B complex at 5.8-angstrom resolution. Our model reveals that in B, the catalytic U2/U6 RNA-Prp8 ribonucleoprotein core is already established, and the 5' splice site (ss) is oriented for step 1 catalysis but occluded by protein. The first-step nucleophile-the branchsite adenosine-is sequestered within the Hsh155 HEAT domain and is held 50 angstroms away from the 5'ss. Our structure suggests that Prp2 adenosine triphosphatase-mediated remodeling leads to conformational changes in Hsh155's HEAT domain that liberate the first-step reactants for catalysis. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  5lqw.cif.gz 5lqw.cif.gz | 683.8 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb5lqw.ent.gz pdb5lqw.ent.gz | 390.3 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  5lqw.json.gz 5lqw.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  5lqw_validation.pdf.gz 5lqw_validation.pdf.gz | 1.1 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  5lqw_full_validation.pdf.gz 5lqw_full_validation.pdf.gz | 1.1 MB | 表示 | |
| XML形式データ |  5lqw_validation.xml.gz 5lqw_validation.xml.gz | 120.7 KB | 表示 | |
| CIF形式データ |  5lqw_validation.cif.gz 5lqw_validation.cif.gz | 191.9 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/lq/5lqw https://data.pdbj.org/pub/pdb/validation_reports/lq/5lqw ftp://data.pdbj.org/pub/pdb/validation_reports/lq/5lqw ftp://data.pdbj.org/pub/pdb/validation_reports/lq/5lqw | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
-Pre-mRNA-splicing factor ... , 14種, 14分子 ABDEFHKLOPRWXY
| #1: タンパク質 | 分子量: 279850.375 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
|---|---|
| #2: タンパク質 | 分子量: 114174.008 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
| #4: タンパク質 | 分子量: 40988.590 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
| #5: タンパク質 | 分子量: 18484.502 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
| #6: タンパク質 | 分子量: 38486.562 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
| #7: タンパク質 | 分子量: 67386.062 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
| #9: タンパク質 | 分子量: 50771.289 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
| #10: タンパク質 | 分子量: 30529.141 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
| #13: タンパク質 | 分子量: 99947.492 Da / 分子数: 1 / Mutation: G551N / 由来タイプ: 組換発現 由来: (組換発現)  遺伝子: PRP2, RNA2, YNR011C, N2048 / 発現宿主:  |
| #14: タンパク質 | 分子量: 100344.016 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
| #16: タンパク質 | 分子量: 82555.859 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
| #17: タンパク質 | 分子量: 67837.773 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
| #18: タンパク質 | 分子量: 153956.781 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
| #19: タンパク質 | 分子量: 12283.573 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
-タンパク質 , 5種, 5分子 CMNZb
| #3: タンパク質 | 分子量: 246470.266 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
|---|---|
| #11: タンパク質 | 分子量: 42548.727 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
| #12: タンパク質 | 分子量: 23685.682 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
| #20: タンパク質 | 分子量: 10045.401 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
| #21: タンパク質 | 分子量: 22426.990 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
-U2 snRNP component ... , 2種, 2分子 JQ
| #8: タンパク質 | 分子量: 17121.127 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
|---|---|
| #15: タンパク質 | 分子量: 110166.672 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
-Small nuclear ribonucleoprotein ... , 6種, 6分子 defghj
| #22: タンパク質 | 分子量: 11240.139 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
|---|---|
| #23: タンパク質 | 分子量: 10385.098 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
| #24: タンパク質 | 分子量: 9669.945 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
| #25: タンパク質 | 分子量: 8490.809 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
| #26: タンパク質 | 分子量: 16296.798 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
| #27: タンパク質 | 分子量: 12876.066 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
-RNA鎖 , 4種, 4分子 2569
| #28: RNA鎖 | 分子量: 376267.406 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
|---|---|
| #29: RNA鎖 | 分子量: 57444.875 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
| #30: RNA鎖 | 分子量: 35883.176 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
| #31: RNA鎖 | 分子量: 182574.875 Da / 分子数: 1 / 由来タイプ: 合成 / 由来: (合成)  |
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: yeast activated spliceosome (BACT) / タイプ: COMPLEX / Entity ID: all / 由来: NATURAL | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 分子量 | 値: 3.8 MDa / 実験値: NO | ||||||||||||||||||||||||
| 由来(天然) | 生物種:  | ||||||||||||||||||||||||
| 緩衝液 | pH: 7.3 | ||||||||||||||||||||||||
| 緩衝液成分 |
| ||||||||||||||||||||||||
| 試料 | 濃度: 0.05 mg/ml / 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES | ||||||||||||||||||||||||
| 試料支持 | グリッドの材料: COPPER / グリッドのサイズ: 200 divisions/in. / グリッドのタイプ: Quantifoil R3.5/1 | ||||||||||||||||||||||||
| 急速凍結 | 装置: FEI VITROBOT MARK IV / 凍結剤: ETHANE / 湿度: 100 % / 凍結前の試料温度: 277 K |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD / 倍率(補正後): 74000 X / Cs: 0.001 mm / C2レンズ絞り径: 100 µm / アライメント法: ZEMLIN TABLEAU |
| 試料ホルダ | 凍結剤: NITROGEN 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER |
| 撮影 | 平均露光時間: 1 sec. / 電子線照射量: 40 e/Å2 / 検出モード: INTEGRATING フィルム・検出器のモデル: FEI FALCON II (4k x 4k) 撮影したグリッド数: 1 |
| 電子光学装置 | 球面収差補正装置: Cs corrector with two hexapoles |
- 解析
解析
| EMソフトウェア |
| ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CTF補正 | タイプ: PHASE FLIPPING ONLY | ||||||||||||||||
| 対称性 | 点対称性: C1 (非対称) | ||||||||||||||||
| 3次元再構成 | 解像度: 5.8 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 122000 / 対称性のタイプ: POINT |
 ムービー
ムービー コントローラー
コントローラー












 PDBj
PDBj