+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 5h09 | ||||||
|---|---|---|---|---|---|---|---|
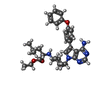
| タイトル | Crystal structure of HCK complexed with a pyrrolo-pyrimidine inhibitor (S)-ethyl2-(((1r,4S)-4-(4-amino-5-(4-phenoxyphenyl)-7H-pyrrolo[2,3-d]pyrimidin-7-yl)cyclohexyl)amino)-4-methylpentanoate | ||||||
 要素 要素 | Tyrosine-protein kinase HCK | ||||||
 キーワード キーワード | TRANSFERASE/TRANSFERASE INHIBITOR / TRANSFERASE-TRANSFERASE INHIBITOR complex | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報leukocyte degranulation / innate immune response-activating signaling pathway / respiratory burst after phagocytosis / leukocyte migration involved in immune response / regulation of podosome assembly / FLT3 signaling through SRC family kinases / regulation of phagocytosis / regulation of DNA-binding transcription factor activity / Nef and signal transduction / positive regulation of actin filament polymerization ...leukocyte degranulation / innate immune response-activating signaling pathway / respiratory burst after phagocytosis / leukocyte migration involved in immune response / regulation of podosome assembly / FLT3 signaling through SRC family kinases / regulation of phagocytosis / regulation of DNA-binding transcription factor activity / Nef and signal transduction / positive regulation of actin filament polymerization / Fc-gamma receptor signaling pathway involved in phagocytosis / mesoderm development / FCGR activation / type II interferon-mediated signaling pathway / transport vesicle / Signaling by CSF3 (G-CSF) / phosphotyrosine residue binding / FCGR3A-mediated IL10 synthesis / Regulation of signaling by CBL / cell surface receptor protein tyrosine kinase signaling pathway / lipopolysaccharide-mediated signaling pathway / peptidyl-tyrosine phosphorylation / integrin-mediated signaling pathway / cell projection / FCGR3A-mediated phagocytosis / regulation of actin cytoskeleton organization / non-membrane spanning protein tyrosine kinase activity / Inactivation of CSF3 (G-CSF) signaling / non-specific protein-tyrosine kinase / negative regulation of inflammatory response to antigenic stimulus / caveola / Signaling by CSF1 (M-CSF) in myeloid cells / cytoplasmic side of plasma membrane / cytokine-mediated signaling pathway / regulation of cell shape / protein autophosphorylation / regulation of inflammatory response / protein tyrosine kinase activity / cell differentiation / cytoskeleton / lysosome / protein phosphorylation / cell adhesion / defense response to Gram-positive bacterium / intracellular signal transduction / inflammatory response / signaling receptor binding / focal adhesion / intracellular membrane-bounded organelle / positive regulation of cell population proliferation / lipid binding / negative regulation of apoptotic process / Golgi apparatus / ATP binding / nucleus / plasma membrane / cytosol 類似検索 - 分子機能 | ||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 1.945 Å 分子置換 / 解像度: 1.945 Å | ||||||
 データ登録者 データ登録者 | Tomabechi, Y. / Kukimoto-Niino, M. / Shirouzu, M. | ||||||
 引用 引用 |  ジャーナル: Bioorg. Med. Chem. / 年: 2017 ジャーナル: Bioorg. Med. Chem. / 年: 2017タイトル: Activity cliff for 7-substituted pyrrolo-pyrimidine inhibitors of HCK explained in terms of predicted basicity of the amine nitrogen. 著者: Yuki, H. / Kikuzato, K. / Koda, Y. / Mikuni, J. / Tomabechi, Y. / Kukimoto-Niino, M. / Tanaka, A. / Shirai, F. / Shirouzu, M. / Koyama, H. / Honma, T. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  5h09.cif.gz 5h09.cif.gz | 114.8 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb5h09.ent.gz pdb5h09.ent.gz | 84.4 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  5h09.json.gz 5h09.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  5h09_validation.pdf.gz 5h09_validation.pdf.gz | 704 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  5h09_full_validation.pdf.gz 5h09_full_validation.pdf.gz | 710.7 KB | 表示 | |
| XML形式データ |  5h09_validation.xml.gz 5h09_validation.xml.gz | 21.1 KB | 表示 | |
| CIF形式データ |  5h09_validation.cif.gz 5h09_validation.cif.gz | 31.1 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/h0/5h09 https://data.pdbj.org/pub/pdb/validation_reports/h0/5h09 ftp://data.pdbj.org/pub/pdb/validation_reports/h0/5h09 ftp://data.pdbj.org/pub/pdb/validation_reports/h0/5h09 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  5h0bC  5h0eC  5h0gC  5h0hC  3vs3S  5h0a  5h0c  5h0d  5h0f C: 同じ文献を引用 ( S: 精密化の開始モデル |
|---|---|
| 類似構造データ |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| 単位格子 |
|
- 要素
要素
| #1: タンパク質 | 分子量: 52000.227 Da / 分子数: 1 / 断片: UNP RESIDUES 81-526 / 変異: Q523E, Q524E, Q525I / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: HCK Homo sapiens (ヒト) / 遺伝子: HCK発現宿主:  参照: UniProt: P08631, non-specific protein-tyrosine kinase |
|---|---|
| #2: 化合物 | ChemComp-OOO / |
| #3: 水 | ChemComp-HOH / |
| Has protein modification | Y |
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.3 Å3/Da / 溶媒含有率: 46.58 % |
|---|---|
| 結晶化 | 温度: 293 K / 手法: 蒸気拡散法, シッティングドロップ法 / 詳細: 0.22-0.25 M ammonium formate, 12-22 % PEG 3350 |
-データ収集
| 回折 | 平均測定温度: 100 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  Photon Factory Photon Factory  / ビームライン: AR-NE3A / 波長: 0.91 Å / ビームライン: AR-NE3A / 波長: 0.91 Å | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 検出器 | タイプ: ADSC QUANTUM 270 / 検出器: CCD / 日付: 2014年2月16日 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 放射波長 | 波長: 0.91 Å / 相対比: 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 反射 | 解像度: 1.95→50 Å / Num. obs: 35580 / % possible obs: 99.9 % / 冗長度: 7.2 % / Biso Wilson estimate: 29.71 Å2 / Rmerge(I) obs: 0.116 / Rpim(I) all: 0.047 / Rrim(I) all: 0.126 / Χ2: 1.939 / Net I/σ(I): 7.4 / Num. measured all: 254528 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 反射 シェル | Diffraction-ID: 1
|
-位相決定
| 位相決定 | 手法:  分子置換 分子置換 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Phasing MR |
|
- 解析
解析
| ソフトウェア |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  分子置換 分子置換開始モデル: 3VS3 解像度: 1.945→28.64 Å / SU ML: 0.19 / 交差検証法: FREE R-VALUE / σ(F): 1.34 / 位相誤差: 22.06 / 立体化学のターゲット値: ML
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | 減衰半径: 0.9 Å / VDWプローブ半径: 1.11 Å / 溶媒モデル: FLAT BULK SOLVENT MODEL | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso max: 145.47 Å2 / Biso mean: 45.5165 Å2 / Biso min: 15.59 Å2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: final / 解像度: 1.945→28.64 Å
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル | Refine-ID: X-RAY DIFFRACTION / Rfactor Rfree error: 0 / Total num. of bins used: 14
|
 ムービー
ムービー コントローラー
コントローラー



















 PDBj
PDBj