+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 5euw | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Rat prestin STAS domain in complex with nitrate | |||||||||
 要素 要素 | Prestin,Prestin | |||||||||
 キーワード キーワード | TRANSPORT PROTEIN / Anion-binding site / protein-anion complex | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報oxalate transport / lateral wall of outer hair cell / fructose transmembrane transport / response to salicylic acid / sulfate transmembrane transporter activity / negative regulation of monoatomic ion transmembrane transport / secondary active sulfate transmembrane transporter activity / oxalate transmembrane transporter activity / response to potassium ion / response to auditory stimulus ...oxalate transport / lateral wall of outer hair cell / fructose transmembrane transport / response to salicylic acid / sulfate transmembrane transporter activity / negative regulation of monoatomic ion transmembrane transport / secondary active sulfate transmembrane transporter activity / oxalate transmembrane transporter activity / response to potassium ion / response to auditory stimulus / monoatomic anion transmembrane transport / chloride:bicarbonate antiporter activity / response to salt / response to thyroid hormone / bicarbonate transport / bicarbonate transmembrane transporter activity / positive regulation of cell motility / chloride transport / chloride transmembrane transporter activity / spectrin binding / cochlea development / cytoskeletal motor activity / positive regulation of cell size / lateral plasma membrane / monoatomic ion transmembrane transport / chloride transmembrane transport / response to ischemia / regulation of membrane potential / sensory perception of sound / regulation of cell shape / basolateral plasma membrane / response to xenobiotic stimulus / protein homodimerization activity / identical protein binding / plasma membrane 類似検索 - 分子機能 | |||||||||
| 生物種 |  | |||||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 1.81 Å 分子置換 / 解像度: 1.81 Å | |||||||||
 データ登録者 データ登録者 | Lolli, G. / Pasqualetto, E. / Costanzi, E. / Bonetto, G. / Battistutta, R. | |||||||||
| 資金援助 |  イタリア, 2件 イタリア, 2件
| |||||||||
 引用 引用 |  ジャーナル: Biochem.J. / 年: 2016 ジャーナル: Biochem.J. / 年: 2016タイトル: The STAS domain of mammalian SLC26A5 prestin harbours an anion-binding site. 著者: Lolli, G. / Pasqualetto, E. / Costanzi, E. / Bonetto, G. / Battistutta, R. #1:  ジャーナル: J.Mol.Biol. / 年: 2010 ジャーナル: J.Mol.Biol. / 年: 2010タイトル: Structure of the Cytosolic Portion of the Motor Protein Prestin and Functional Role of the STAS Domain in SLC26/SulP Anion Transporters 著者: Pasqualetto, E. / Aiello, R. / Gesiot, L. / Bonetto, G. / Bellanda, M. / Battistutta, R. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  5euw.cif.gz 5euw.cif.gz | 92.8 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb5euw.ent.gz pdb5euw.ent.gz | 71 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  5euw.json.gz 5euw.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  5euw_validation.pdf.gz 5euw_validation.pdf.gz | 457 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  5euw_full_validation.pdf.gz 5euw_full_validation.pdf.gz | 457.4 KB | 表示 | |
| XML形式データ |  5euw_validation.xml.gz 5euw_validation.xml.gz | 8.4 KB | 表示 | |
| CIF形式データ |  5euw_validation.cif.gz 5euw_validation.cif.gz | 10.8 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/eu/5euw https://data.pdbj.org/pub/pdb/validation_reports/eu/5euw ftp://data.pdbj.org/pub/pdb/validation_reports/eu/5euw ftp://data.pdbj.org/pub/pdb/validation_reports/eu/5euw | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| 単位格子 |
|
- 要素
要素
-タンパク質 , 1種, 1分子 A
| #1: タンパク質 | 分子量: 15766.707 Da / 分子数: 1 / 断片: STAS domain,STAS domain 変異: Residues 564-636 (variable loop) are deleted, GlySer are inserted between position 563 and 637,Residues 564-636 (variable loop) are deleted, GlySer are inserted between position 563 and 637 由来タイプ: 組換発現 詳細: Residues 564-636 (variable loop) are deleted, GlySer are inserted between position 563 and 637 由来: (組換発現)   |
|---|
-非ポリマー , 5種, 101分子 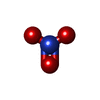







| #2: 化合物 | ChemComp-NO3 / | ||||||
|---|---|---|---|---|---|---|---|
| #3: 化合物 | | #4: 化合物 | ChemComp-PG4 / | #5: 化合物 | #6: 水 | ChemComp-HOH / | |
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.37 Å3/Da / 溶媒含有率: 48.11 % |
|---|---|
| 結晶化 | 温度: 293 K / 手法: 蒸気拡散法, シッティングドロップ法 / pH: 6.5 詳細: 0.1 M Mes pH 6.5, 1.8 M Ammonium Sulphate, 100 mM NaNO3, 5% (w/v) PEG400, 0.1% (w/v) octyl-beta-D-glucopyranoside |
-データ収集
| 回折 | 平均測定温度: 100 K |
|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  ELETTRA ELETTRA  / ビームライン: 5.2R / 波長: 1.2 Å / ビームライン: 5.2R / 波長: 1.2 Å |
| 検出器 | タイプ: DECTRIS PILATUS 2M / 検出器: PIXEL / 日付: 2012年11月20日 |
| 放射 | モノクロメーター: Si(111) / プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長: 1.2 Å / 相対比: 1 |
| 反射 | 解像度: 1.81→41.96 Å / Num. all: 89717 / Num. obs: 14062 / % possible obs: 99.9 % / 冗長度: 6.4 % / Rmerge(I) obs: 0.075 / Rsym value: 0.082 / Net I/σ(I): 15 |
| 反射 シェル | 解像度: 1.81→1.85 Å / 冗長度: 6.2 % / Rmerge(I) obs: 1.143 / Mean I/σ(I) obs: 1.7 / % possible all: 97.2 |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  分子置換 分子置換開始モデル: 3LLO 解像度: 1.81→41.959 Å / SU ML: 0.22 / 交差検証法: FREE R-VALUE / σ(F): 1.35 / 位相誤差: 19.9 / 立体化学のターゲット値: ML
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | 減衰半径: 0.9 Å / VDWプローブ半径: 1.11 Å / 溶媒モデル: FLAT BULK SOLVENT MODEL | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso max: 122.62 Å2 / Biso mean: 39.0268 Å2 / Biso min: 15.96 Å2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: final / 解像度: 1.81→41.959 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル | Refine-ID: X-RAY DIFFRACTION / Total num. of bins used: 6
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 TLS | 手法: refined / Refine-ID: X-RAY DIFFRACTION
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 TLSグループ |
|
 ムービー
ムービー コントローラー
コントローラー



















 PDBj
PDBj




