| 登録情報 | データベース: PDB / ID: 5d9w
|
|---|
| タイトル | Dehydroascorbate reductase (OsDHAR) complexed with ASA |
|---|
 要素 要素 | Dehydroascorbate reductase |
|---|
 キーワード キーワード | PLANT PROTEIN / OsDHAR / Oryza sativa L. japonica / ascorbate |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
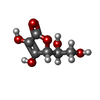
positive regulation of salicylic acid mediated signaling pathway / ascorbate glutathione cycle / glutathione dehydrogenase (ascorbate) activity / glutathione dehydrogenase (ascorbate) / cellular oxidant detoxification / glutathione transferase / glutathione transferase activity / cytosol類似検索 - 分子機能 Dehydroascorbate reductases DHAR1/2/3/4 / Glutathione S-transferase, C-terminal domain / Glutathione S-transferase, N-terminal domain / Glutathione transferase family / Glutathione S-transferase Yfyf (Class Pi); Chain A, domain 2 - #10 / Glutathione S-transferase Yfyf (Class Pi); Chain A, domain 2 / Glutathione S-transferase, C-terminal-like / Soluble glutathione S-transferase C-terminal domain profile. / Soluble glutathione S-transferase N-terminal domain profile. / Glutathione S-transferase, N-terminal ...Dehydroascorbate reductases DHAR1/2/3/4 / Glutathione S-transferase, C-terminal domain / Glutathione S-transferase, N-terminal domain / Glutathione transferase family / Glutathione S-transferase Yfyf (Class Pi); Chain A, domain 2 - #10 / Glutathione S-transferase Yfyf (Class Pi); Chain A, domain 2 / Glutathione S-transferase, C-terminal-like / Soluble glutathione S-transferase C-terminal domain profile. / Soluble glutathione S-transferase N-terminal domain profile. / Glutathione S-transferase, N-terminal / Glutathione S-transferase, C-terminal domain superfamily / Glutaredoxin / Glutaredoxin / Thioredoxin-like superfamily / Up-down Bundle / 3-Layer(aba) Sandwich / Mainly Alpha / Alpha Beta類似検索 - ドメイン・相同性 ASCORBIC ACID / Probable glutathione S-transferase DHAR1, cytosolic類似検索 - 構成要素 |
|---|
| 生物種 |   Oryza sativa subsp. japonica (イネ) Oryza sativa subsp. japonica (イネ) |
|---|
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 1.6897 Å 分子置換 / 解像度: 1.6897 Å |
|---|
 データ登録者 データ登録者 | Do, H. / Lee, J.H. |
|---|
| 資金援助 |  韓国, 2件 韓国, 2件 | 組織 | 認可番号 | 国 |
|---|
| Korea Polar Research Institute | PE15070 |  韓国 韓国 | | Rural Development Administration | PJ011122 |  韓国 韓国 |
|
|---|
 引用 引用 |  ジャーナル: Sci Rep / 年: 2016 ジャーナル: Sci Rep / 年: 2016
タイトル: Structural understanding of the recycling of oxidized ascorbate by dehydroascorbate reductase (OsDHAR) from Oryza sativa L. japonica
著者: Do, H. / Kim, I.S. / Jeon, B.W. / Lee, C.W. / Park, A.K. / Wi, A.R. / Shin, S.C. / Park, H. / Kim, Y.S. / Yoon, H.S. / Kim, H.W. / Lee, J.H. |
|---|
| 履歴 | | 登録 | 2015年8月19日 | 登録サイト: RCSB / 処理サイト: PDBJ |
|---|
| 改定 1.0 | 2016年2月3日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2020年7月29日 | Group: Data collection / Derived calculations
カテゴリ: chem_comp / pdbx_struct_oper_list ...chem_comp / pdbx_struct_oper_list / struct_site / struct_site_gen
Item: _chem_comp.type / _pdbx_struct_oper_list.symmetry_operation
解説: Carbohydrate remediation / Provider: repository / タイプ: Remediation |
|---|
| 改定 1.2 | 2024年3月20日 | Group: Data collection / Database references / Structure summary
カテゴリ: chem_comp / chem_comp_atom ...chem_comp / chem_comp_atom / chem_comp_bond / database_2
Item: _chem_comp.pdbx_synonyms / _database_2.pdbx_DOI / _database_2.pdbx_database_accession |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報
 X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  分子置換 / 解像度: 1.6897 Å
分子置換 / 解像度: 1.6897 Å  データ登録者
データ登録者 韓国, 2件
韓国, 2件  引用
引用 ジャーナル: Sci Rep / 年: 2016
ジャーナル: Sci Rep / 年: 2016 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 5d9w.cif.gz
5d9w.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb5d9w.ent.gz
pdb5d9w.ent.gz PDB形式
PDB形式 5d9w.json.gz
5d9w.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 5d9w_validation.pdf.gz
5d9w_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 5d9w_full_validation.pdf.gz
5d9w_full_validation.pdf.gz 5d9w_validation.xml.gz
5d9w_validation.xml.gz 5d9w_validation.cif.gz
5d9w_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/d9/5d9w
https://data.pdbj.org/pub/pdb/validation_reports/d9/5d9w ftp://data.pdbj.org/pub/pdb/validation_reports/d9/5d9w
ftp://data.pdbj.org/pub/pdb/validation_reports/d9/5d9w リンク
リンク 集合体
集合体
 要素
要素

 X線回折
X線回折 試料調製
試料調製 シンクロトロン / サイト: PAL/PLS
シンクロトロン / サイト: PAL/PLS  / ビームライン: 7A (6B, 6C1) / 波長: 1 Å
/ ビームライン: 7A (6B, 6C1) / 波長: 1 Å 解析
解析 分子置換 / 解像度: 1.6897→28.611 Å / SU ML: 0.19 / 交差検証法: FREE R-VALUE / σ(F): 1.35 / 位相誤差: 27.17 / 立体化学のターゲット値: ML
分子置換 / 解像度: 1.6897→28.611 Å / SU ML: 0.19 / 交差検証法: FREE R-VALUE / σ(F): 1.35 / 位相誤差: 27.17 / 立体化学のターゲット値: ML ムービー
ムービー コントローラー
コントローラー















 PDBj
PDBj