+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 5c47 | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | Crystal structure of ABBB + UDP-C-Gal (long soak) + DI | ||||||
 要素 要素 | Histo-blood group ABO system transferase | ||||||
 キーワード キーワード | TRANSFERASE / Human ABO(H) glycosyltransferases Non-hydrolyzable substrate analogs Chimeric enzyme | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報fucosylgalactoside 3-alpha-galactosyltransferase / glycoprotein-fucosylgalactoside alpha-N-acetylgalactosaminyltransferase / glycoprotein-fucosylgalactoside alpha-N-acetylgalactosaminyltransferase activity / fucosylgalactoside 3-alpha-galactosyltransferase activity / ABO blood group biosynthesis / : / Golgi cisterna membrane / : / antigen binding / manganese ion binding ...fucosylgalactoside 3-alpha-galactosyltransferase / glycoprotein-fucosylgalactoside alpha-N-acetylgalactosaminyltransferase / glycoprotein-fucosylgalactoside alpha-N-acetylgalactosaminyltransferase activity / fucosylgalactoside 3-alpha-galactosyltransferase activity / ABO blood group biosynthesis / : / Golgi cisterna membrane / : / antigen binding / manganese ion binding / vesicle / carbohydrate metabolic process / Golgi membrane / nucleotide binding / Golgi apparatus / extracellular region 類似検索 - 分子機能 | ||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 |  X線回折 / X線回折 /  分子置換 / 解像度: 1.39 Å 分子置換 / 解像度: 1.39 Å | ||||||
 データ登録者 データ登録者 | Gagnon, S. / Meloncelli, P. / Zheng, R.B. / Haji-Ghassemi, O. / Johal, A.R. / Borisova, S. / Lowary, T.L. / Evans, S.V. | ||||||
| 資金援助 |  カナダ, 1件 カナダ, 1件
| ||||||
 引用 引用 |  ジャーナル: J.Biol.Chem. / 年: 2015 ジャーナル: J.Biol.Chem. / 年: 2015タイトル: High Resolution Structures of the Human ABO(H) Blood Group Enzymes in Complex with Donor Analogs Reveal That the Enzymes Utilize Multiple Donor Conformations to Bind Substrates in a Stepwise Manner. 著者: Gagnon, S.M. / Meloncelli, P.J. / Zheng, R.B. / Haji-Ghassemi, O. / Johal, A.R. / Borisova, S.N. / Lowary, T.L. / Evans, S.V. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  5c47.cif.gz 5c47.cif.gz | 85.9 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb5c47.ent.gz pdb5c47.ent.gz | 60.4 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  5c47.json.gz 5c47.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  5c47_validation.pdf.gz 5c47_validation.pdf.gz | 1.1 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  5c47_full_validation.pdf.gz 5c47_full_validation.pdf.gz | 1.1 MB | 表示 | |
| XML形式データ |  5c47_validation.xml.gz 5c47_validation.xml.gz | 15.8 KB | 表示 | |
| CIF形式データ |  5c47_validation.cif.gz 5c47_validation.cif.gz | 23.2 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/c4/5c47 https://data.pdbj.org/pub/pdb/validation_reports/c4/5c47 ftp://data.pdbj.org/pub/pdb/validation_reports/c4/5c47 ftp://data.pdbj.org/pub/pdb/validation_reports/c4/5c47 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  5bxcC  5c1gC  5c1hC  5c1lC  5c36C  5c38C  5c3aC  5c3bC  5c3dC  5c48C  5c49C  5c4bC  5c4cC  5c4dC  5c4eC  5c4fC  5c8rC  1lz7S C: 同じ文献を引用 ( S: 精密化の開始モデル |
|---|---|
| 類似構造データ |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||
| 単位格子 |
|
- 要素
要素
-タンパク質 , 1種, 1分子 A
| #1: タンパク質 | 分子量: 34756.098 Da / 分子数: 1 / 断片: UNP residues 64-354 / 変異: G235S, L266M, G268A / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: ABO / 発現宿主: Homo sapiens (ヒト) / 遺伝子: ABO / 発現宿主:  参照: UniProt: P16442, glycoprotein-fucosylgalactoside alpha-N-acetylgalactosaminyltransferase, fucosylgalactoside 3-alpha-galactosyltransferase |
|---|
-非ポリマー , 5種, 247分子 





| #2: 化合物 | ChemComp-MN / |
|---|---|
| #3: 化合物 | ChemComp-DA8 / |
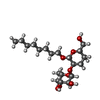
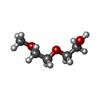
| #4: 化合物 | ChemComp-PG0 / |
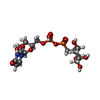
| #5: 化合物 | ChemComp-URM / ((( |
| #6: 水 | ChemComp-HOH / |
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.29 Å3/Da / 溶媒含有率: 46.37 % |
|---|---|
| 結晶化 | 温度: 277 K / 手法: 蒸気拡散法, ハンギングドロップ法 詳細: Grown in 1% polyethylene glycol (PEG) 4000, 4.5-5% 2-methyl-2,4-pentanediol (MPD), 100 mM ammonium sulfate, 70 mM sodium chloride, 50 mM N-[-acetamido]-2-iminodiacetic acid (ADA), 30 mM ...詳細: Grown in 1% polyethylene glycol (PEG) 4000, 4.5-5% 2-methyl-2,4-pentanediol (MPD), 100 mM ammonium sulfate, 70 mM sodium chloride, 50 mM N-[-acetamido]-2-iminodiacetic acid (ADA), 30 mM sodium acetate, 5 mM manganese chloride. Grown 5-10 days. |
-データ収集
| 回折 | 平均測定温度: 113 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 放射光源 | 由来:  回転陽極 / タイプ: RIGAKU / 波長: 1.5418 Å 回転陽極 / タイプ: RIGAKU / 波長: 1.5418 Å | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 検出器 | タイプ: RIGAKU RAXIS IV++ / 検出器: IMAGE PLATE / 日付: 2007年10月25日 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 放射波長 | 波長: 1.5418 Å / 相対比: 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 反射 | 解像度: 1.39→19.77 Å / Num. obs: 61958 / % possible obs: 98 % / 冗長度: 4.05 % / Rmerge(I) obs: 0.032 / Χ2: 0.97 / Net I/σ(I): 22.5 / Num. measured all: 252937 / Scaling rejects: 1898 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 反射 シェル | Diffraction-ID: 1
|
- 解析
解析
| ソフトウェア |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  分子置換 分子置換開始モデル: 1LZ7 解像度: 1.39→6 Å / Cor.coef. Fo:Fc: 0.97 / Cor.coef. Fo:Fc free: 0.962 / SU B: 0.867 / SU ML: 0.035 / 交差検証法: THROUGHOUT / σ(F): 0 / ESU R: 0.06 / ESU R Free: 0.061 / 立体化学のターゲット値: MAXIMUM LIKELIHOOD 詳細: HYDROGENS HAVE BEEN ADDED IN THE RIDING POSITIONS U VALUES : REFINED INDIVIDUALLY
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | イオンプローブ半径: 0.8 Å / 減衰半径: 0.8 Å / VDWプローブ半径: 1.2 Å / 溶媒モデル: MASK | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso max: 167.14 Å2 / Biso mean: 19.461 Å2 / Biso min: 10.09 Å2
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: final / 解像度: 1.39→6 Å
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル | 解像度: 1.39→1.424 Å / Total num. of bins used: 20
|
 ムービー
ムービー コントローラー
コントローラー














 PDBj
PDBj





