+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 4ysx | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | Crystal structure of Mitochondrial rhodoquinol-fumarate reductase from Ascaris suum with the specific inhibitor NN23 | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード | OXIDOREDUCTASE/OXIDOREDUCTASE INHIBITOR / rhodoquinol-fumarate reductase / Complex II / OXIDOREDUCTASE-OXIDOREDUCTASE INHIBITOR complex | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報respiratory chain complex II (succinate dehydrogenase) / mitochondrial electron transport, succinate to ubiquinone / succinate dehydrogenase (quinone) activity / succinate dehydrogenase / 3 iron, 4 sulfur cluster binding / ubiquinone binding / tricarboxylic acid cycle / mitochondrial membrane / 2 iron, 2 sulfur cluster binding / 4 iron, 4 sulfur cluster binding ...respiratory chain complex II (succinate dehydrogenase) / mitochondrial electron transport, succinate to ubiquinone / succinate dehydrogenase (quinone) activity / succinate dehydrogenase / 3 iron, 4 sulfur cluster binding / ubiquinone binding / tricarboxylic acid cycle / mitochondrial membrane / 2 iron, 2 sulfur cluster binding / 4 iron, 4 sulfur cluster binding / electron transfer activity / mitochondrial inner membrane / heme binding / metal ion binding 類似検索 - 分子機能 | ||||||
| 生物種 |  Ascaris suum (かいちゅう) Ascaris suum (かいちゅう) | ||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 2.25 Å 分子置換 / 解像度: 2.25 Å | ||||||
 データ登録者 データ登録者 | Harada, S. / Shiba, T. / Sato, D. / Yamamoto, A. / Nagahama, M. / Yone, A. / Inaoka, D.K. / Sakamoto, K. / Inoue, M. / Honma, T. / Kita, K. | ||||||
 引用 引用 |  ジャーナル: Int J Mol Sci / 年: 2015 ジャーナル: Int J Mol Sci / 年: 2015タイトル: Structural Insights into the Molecular Design of Flutolanil Derivatives Targeted for Fumarate Respiration of Parasite Mitochondria 著者: Inaoka, D.K. / Shiba, T. / Sato, D. / Balogun, E.O. / Sasaki, T. / Nagahama, M. / Oda, M. / Matsuoka, S. / Ohmori, J. / Honma, T. / Inoue, M. / Kita, K. / Harada, S. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  4ysx.cif.gz 4ysx.cif.gz | 488.6 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb4ysx.ent.gz pdb4ysx.ent.gz | 389.1 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  4ysx.json.gz 4ysx.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  4ysx_validation.pdf.gz 4ysx_validation.pdf.gz | 2.6 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  4ysx_full_validation.pdf.gz 4ysx_full_validation.pdf.gz | 2.6 MB | 表示 | |
| XML形式データ |  4ysx_validation.xml.gz 4ysx_validation.xml.gz | 91.7 KB | 表示 | |
| CIF形式データ |  4ysx_validation.cif.gz 4ysx_validation.cif.gz | 125.4 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/ys/4ysx https://data.pdbj.org/pub/pdb/validation_reports/ys/4ysx ftp://data.pdbj.org/pub/pdb/validation_reports/ys/4ysx ftp://data.pdbj.org/pub/pdb/validation_reports/ys/4ysx | HTTPS FTP |
-関連構造データ
| 関連構造データ |  3abvC  3ae7C  3ae9C  3aeaC  4ysyC  4yszC  4yt0C  4ytmC  4ytpC  4yxdC  5c2tC  3vrbS S: 精密化の開始モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||
| 2 | 
| ||||||||
| 単位格子 |
|
- 要素
要素
-タンパク質 , 2種, 4分子 AECG
| #1: タンパク質 | 分子量: 71392.203 Da / 分子数: 2 / 由来タイプ: 天然 / 由来: (天然)  Ascaris suum (かいちゅう) / 参照: UniProt: U1LRQ3 Ascaris suum (かいちゅう) / 参照: UniProt: U1LRQ3#3: タンパク質 | 分子量: 21168.160 Da / 分子数: 2 / 由来タイプ: 天然 / 由来: (天然)  Ascaris suum (かいちゅう) / 参照: UniProt: P92506, UniProt: F1LC27*PLUS Ascaris suum (かいちゅう) / 参照: UniProt: P92506, UniProt: F1LC27*PLUS |
|---|
-Succinate dehydrogenase [ubiquinone] ... , 2種, 4分子 BFDH
| #2: タンパク質 | 分子量: 31673.951 Da / 分子数: 2 / 由来タイプ: 天然 / 由来: (天然)  Ascaris suum (かいちゅう) / 参照: UniProt: O44074, succinate dehydrogenase Ascaris suum (かいちゅう) / 参照: UniProt: O44074, succinate dehydrogenase#4: タンパク質 | 分子量: 17014.932 Da / 分子数: 2 / 由来タイプ: 天然 / 由来: (天然)  Ascaris suum (かいちゅう) / 参照: UniProt: P92507 Ascaris suum (かいちゅう) / 参照: UniProt: P92507 |
|---|
-非ポリマー , 9種, 737分子 




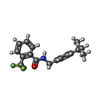










| #5: 化合物 | | #6: 化合物 | #7: 化合物 | #8: 化合物 | #9: 化合物 | #10: 化合物 | #11: 化合物 | #12: 化合物 | #13: 水 | ChemComp-HOH / | |
|---|
-詳細
| Has protein modification | Y |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 3.1 Å3/Da / 溶媒含有率: 60.32 % |
|---|---|
| 結晶化 | 温度: 293 K / 手法: microdialysis / pH: 8.4 詳細: 15% (W/V) PEG 3350, 100MM TRIS-HCL, 200MM NACL, 1MM SODIUM MALONATE, 0.06% (W/V) C12E8, 0.04% (W/V) C12M |
-データ収集
| 回折 | 平均測定温度: 100 K |
|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  SPring-8 SPring-8  / ビームライン: BL44XU / 波長: 0.9 Å / ビームライン: BL44XU / 波長: 0.9 Å |
| 検出器 | タイプ: RAYONIX MX-300 / 検出器: CCD / 日付: 2013年10月11日 |
| 放射 | モノクロメーター: double-crystal Si(111) / プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長: 0.9 Å / 相対比: 1 |
| 反射 | 解像度: 2.25→50 Å / Num. obs: 166618 / % possible obs: 96.4 % / 冗長度: 5.7 % / Rmerge(I) obs: 0.082 / Net I/σ(I): 11.4 |
| 反射 シェル | 解像度: 2.25→2.29 Å / 冗長度: 4.8 % / Rmerge(I) obs: 0.566 / Mean I/σ(I) obs: 2.9 / % possible all: 91.6 |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  分子置換 分子置換開始モデル: 3VRB 解像度: 2.25→20 Å / Cor.coef. Fo:Fc: 0.962 / Cor.coef. Fo:Fc free: 0.944 / SU B: 5.422 / SU ML: 0.132 / 交差検証法: THROUGHOUT / ESU R: 0.211 / ESU R Free: 0.181 / 立体化学のターゲット値: MAXIMUM LIKELIHOOD / 詳細: HYDROGENS HAVE BEEN ADDED IN THE RIDING POSITIONS
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | イオンプローブ半径: 0.8 Å / 減衰半径: 0.8 Å / VDWプローブ半径: 1.2 Å / 溶媒モデル: MASK | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 49.35 Å2
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 2.25→20 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー

















 PDBj
PDBj



















