登録情報 データベース : PDB / ID : 4xl8タイトル Crystal Structure of Human Adenovirus 52 Short Fiber Knob in Complex with 2-O-Methyl-5-N-Acetylneuraminic Acid Fiber-1 キーワード / / / / 機能・相同性 分子機能 ドメイン・相同性 構成要素
/ / / / / / / / / / / / / / / / / 生物種 手法 / / / 解像度 : 1.65 Å データ登録者 Stehle, T. / Liaci, A.M. 資金援助 組織 認可番号 国 German Research Foundation SFB 685
ジャーナル : Plos Pathog. / 年 : 2015タイトル : Human Adenovirus 52 Uses Sialic Acid-containing Glycoproteins and the Coxsackie and Adenovirus Receptor for Binding to Target Cells.著者 : Lenman, A. / Liaci, A.M. / Liu, Y. / Ardahl, C. / Rajan, A. / Nilsson, E. / Bradford, W. / Kaeshammer, L. / Jones, M.S. / Frangsmyr, L. / Feizi, T. / Stehle, T. / Arnberg, N. 履歴 登録 2015年1月13日 登録サイト / 処理サイト 改定 1.0 2015年1月21日 Provider / タイプ 改定 1.1 2015年2月11日 Group 改定 1.2 2015年3月4日 Group 改定 1.3 2015年7月22日 Group 改定 2.0 2017年9月6日 Group Advisory / Atomic model ... Advisory / Atomic model / Author supporting evidence / Derived calculations カテゴリ atom_site / atom_site_anisotrop ... atom_site / atom_site_anisotrop / pdbx_audit_support / pdbx_validate_close_contact / pdbx_validate_symm_contact / struct_site_gen Item _atom_site.B_iso_or_equiv / _atom_site.Cartn_x ... _atom_site.B_iso_or_equiv / _atom_site.Cartn_x / _atom_site.Cartn_y / _atom_site.Cartn_z / _atom_site.occupancy / _atom_site_anisotrop.U[1][1] / _atom_site_anisotrop.U[1][2] / _atom_site_anisotrop.U[1][3] / _atom_site_anisotrop.U[2][2] / _atom_site_anisotrop.U[2][3] / _atom_site_anisotrop.U[3][3] / _atom_site_anisotrop.id / _atom_site_anisotrop.pdbx_auth_seq_id / _pdbx_audit_support.funding_organization / _pdbx_validate_close_contact.auth_seq_id_1 / _pdbx_validate_close_contact.auth_seq_id_2 / _pdbx_validate_symm_contact.auth_seq_id_2 / _struct_site_gen.auth_seq_id 改定 2.1 2019年10月16日 Group / カテゴリ / reflns_shell / Item / _reflns_shell.pdbx_CC_half改定 2.2 2020年7月29日 Group / Derived calculations / Structure summaryカテゴリ chem_comp / entity ... chem_comp / entity / pdbx_chem_comp_identifier / pdbx_entity_nonpoly / struct_site / struct_site_gen Item _chem_comp.mon_nstd_flag / _chem_comp.name ... _chem_comp.mon_nstd_flag / _chem_comp.name / _chem_comp.type / _entity.pdbx_description / _pdbx_entity_nonpoly.name 解説 / Provider / タイプ 改定 2.3 2024年1月10日 Group Data collection / Database references ... Data collection / Database references / Refinement description / Structure summary カテゴリ chem_comp / chem_comp_atom ... chem_comp / chem_comp_atom / chem_comp_bond / database_2 / pdbx_initial_refinement_model Item / _database_2.pdbx_DOI / _database_2.pdbx_database_accession
すべて表示 表示を減らす
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Human adenovirus 52 (ヒトアデノウイルス)
Human adenovirus 52 (ヒトアデノウイルス) X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  分子置換 / 解像度: 1.65 Å
分子置換 / 解像度: 1.65 Å  データ登録者
データ登録者 ドイツ, 1件
ドイツ, 1件  引用
引用 ジャーナル: Plos Pathog. / 年: 2015
ジャーナル: Plos Pathog. / 年: 2015 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 4xl8.cif.gz
4xl8.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb4xl8.ent.gz
pdb4xl8.ent.gz PDB形式
PDB形式 4xl8.json.gz
4xl8.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード https://data.pdbj.org/pub/pdb/validation_reports/xl/4xl8
https://data.pdbj.org/pub/pdb/validation_reports/xl/4xl8 ftp://data.pdbj.org/pub/pdb/validation_reports/xl/4xl8
ftp://data.pdbj.org/pub/pdb/validation_reports/xl/4xl8
 リンク
リンク 集合体
集合体
 要素
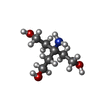
要素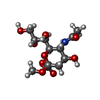

 Human adenovirus 52 (ヒトアデノウイルス)
Human adenovirus 52 (ヒトアデノウイルス)











 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  SLS
SLS  / ビームライン: X06DA / 波長: 1 Å
/ ビームライン: X06DA / 波長: 1 Å 解析
解析 分子置換
分子置換 ムービー
ムービー コントローラー
コントローラー













 PDBj
PDBj










