[English] 日本語
 Yorodumi
Yorodumi- PDB-4lop: Structural basis of autoactivation of p38 alpha induced by TAB1 (... -
+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 4lop | ||||||
|---|---|---|---|---|---|---|---|
| Title | Structural basis of autoactivation of p38 alpha induced by TAB1 (Tetragonal crystal form) | ||||||
 Components Components |
| ||||||
 Keywords Keywords | TRANSFERASE / Structural Genomics / Structural Genomics Consortium / SGC / protein kinase / kinase-regulatory protein complex / MAPK / autoactivation / autophosphorylation | ||||||
| Function / homology |  Function and homology information Function and homology informationIRAK2 mediated activation of TAK1 complex / Alpha-protein kinase 1 signaling pathway / JNK (c-Jun kinases) phosphorylation and activation mediated by activated human TAK1 / TRAF6-mediated induction of TAK1 complex within TLR4 complex / IRAK2 mediated activation of TAK1 complex upon TLR7/8 or 9 stimulation / TNFR1-induced NF-kappa-B signaling pathway / cardiac septum development / TAK1-dependent IKK and NF-kappa-B activation / protein exit from endoplasmic reticulum / FCERI mediated NF-kB activation ...IRAK2 mediated activation of TAK1 complex / Alpha-protein kinase 1 signaling pathway / JNK (c-Jun kinases) phosphorylation and activation mediated by activated human TAK1 / TRAF6-mediated induction of TAK1 complex within TLR4 complex / IRAK2 mediated activation of TAK1 complex upon TLR7/8 or 9 stimulation / TNFR1-induced NF-kappa-B signaling pathway / cardiac septum development / TAK1-dependent IKK and NF-kappa-B activation / protein exit from endoplasmic reticulum / FCERI mediated NF-kB activation / CLEC7A (Dectin-1) signaling / Interleukin-1 signaling / p38MAPK events / Activation of the AP-1 family of transcription factors / Platelet sensitization by LDL / RHO GTPases Activate NADPH Oxidases / ERK/MAPK targets / myoblast differentiation involved in skeletal muscle regeneration / NLRP1 inflammasome complex assembly / Regulation of MITF-M-dependent genes involved in pigmentation / activated TAK1 mediates p38 MAPK activation / NOD1/2 Signaling Pathway / Oxidative Stress Induced Senescence / ADP signalling through P2Y purinoceptor 1 / Regulation of TP53 Activity through Phosphorylation / Myogenesis / positive regulation of cGAS/STING signaling pathway / Ub-specific processing proteases / VEGFA-VEGFR2 Pathway / coronary vasculature development / kinase activator activity / regulation of synaptic membrane adhesion / cGAS/STING signaling pathway / stress-induced premature senescence / cell surface receptor protein serine/threonine kinase signaling pathway / stress-activated protein kinase signaling cascade / positive regulation of myoblast fusion / cellular response to UV-B / aorta development / cartilage condensation / mitogen-activated protein kinase p38 binding / non-canonical NF-kappaB signal transduction / positive regulation of myotube differentiation / NFAT protein binding / regulation of cytokine production involved in inflammatory response / p38MAPK cascade / cellular response to lipoteichoic acid / response to dietary excess / fatty acid oxidation / response to muramyl dipeptide / protein serine/threonine phosphatase activity / pyroptotic inflammatory response / MAP kinase activity / cellular response to vascular endothelial growth factor stimulus / regulation of ossification / mitogen-activated protein kinase / vascular endothelial growth factor receptor signaling pathway / chondrocyte differentiation / negative regulation of hippo signaling / positive regulation of myoblast differentiation / canonical NF-kappaB signal transduction / stress-activated MAPK cascade / skeletal muscle tissue development / heart morphogenesis / positive regulation of cardiac muscle cell proliferation / positive regulation of brown fat cell differentiation / positive regulation of type I interferon production / signal transduction in response to DNA damage / response to muscle stretch / striated muscle cell differentiation / Neutrophil degranulation / positive regulation of interleukin-12 production / transforming growth factor beta receptor signaling pathway / lung development / positive regulation of erythrocyte differentiation / osteoclast differentiation / lipopolysaccharide-mediated signaling pathway / placenta development / DNA damage checkpoint signaling / tumor necrosis factor-mediated signaling pathway / protein serine/threonine kinase activator activity / positive regulation of D-glucose import across plasma membrane / cellular response to ionizing radiation / protein maturation / negative regulation of canonical Wnt signaling pathway / cellular response to virus / positive regulation of protein import into nucleus / bone development / response to insulin / positive regulation of reactive oxygen species metabolic process / glucose metabolic process / cell morphogenesis / spindle pole / osteoblast differentiation / kinase activity / cellular response to tumor necrosis factor / MAPK cascade / cellular response to lipopolysaccharide / angiogenesis / protein phosphatase binding Similarity search - Function | ||||||
| Biological species |  | ||||||
| Method |  X-RAY DIFFRACTION / X-RAY DIFFRACTION /  SYNCHROTRON / SYNCHROTRON /  MOLECULAR REPLACEMENT / Resolution: 2.049 Å MOLECULAR REPLACEMENT / Resolution: 2.049 Å | ||||||
 Authors Authors | Chaikuad, A. / DeNicola, G.F. / Krojer, T. / Allerston, C.K. / von Delft, F. / Arrowsmith, C.H. / Edwards, A.M. / Bountra, C. / Marber, M.S. / Knapp, S. / Structural Genomics Consortium (SGC) | ||||||
 Citation Citation |  Journal: Nat.Struct.Mol.Biol. / Year: 2013 Journal: Nat.Struct.Mol.Biol. / Year: 2013Title: Mechanism and consequence of the autoactivation of p38 alpha mitogen-activated protein kinase promoted by TAB1. Authors: De Nicola, G.F. / Martin, E.D. / Chaikuad, A. / Bassi, R. / Clark, J. / Martino, L. / Verma, S. / Sicard, P. / Tata, R. / Atkinson, R.A. / Knapp, S. / Conte, M.R. / Marber, M.S. | ||||||
| History |
|
- Structure visualization
Structure visualization
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  4lop.cif.gz 4lop.cif.gz | 606.6 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb4lop.ent.gz pdb4lop.ent.gz | 503.9 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  4lop.json.gz 4lop.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/lo/4lop https://data.pdbj.org/pub/pdb/validation_reports/lo/4lop ftp://data.pdbj.org/pub/pdb/validation_reports/lo/4lop ftp://data.pdbj.org/pub/pdb/validation_reports/lo/4lop | HTTPS FTP |
|---|
-Related structure data
| Related structure data |  4looC  4loqC  3queS S: Starting model for refinement C: citing same article ( |
|---|---|
| Similar structure data |
- Links
Links
- Assembly
Assembly
| Deposited unit | 
| ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||||||||||||||
| 2 | 
| ||||||||||||||||||||
| 3 | 
| ||||||||||||||||||||
| 4 | 
| ||||||||||||||||||||
| Unit cell |
| ||||||||||||||||||||
| Noncrystallographic symmetry (NCS) | NCS oper:
|
- Components
Components
-Protein / Protein/peptide , 2 types, 8 molecules ABCDKLMN
| #1: Protein | Mass: 41395.211 Da / Num. of mol.: 4 / Fragment: kinase domain (1-360) Source method: isolated from a genetically manipulated source Source: (gene. exp.)   References: UniProt: P47811, mitogen-activated protein kinase #2: Protein/peptide | Mass: 3102.515 Da / Num. of mol.: 4 / Fragment: residues 384-412 / Source method: obtained synthetically / Details: synthetic peptide / Source: (synth.)  |
|---|
-Non-polymers , 4 types, 886 molecules 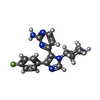
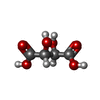





| #3: Chemical | ChemComp-SB4 / #4: Chemical | #5: Chemical | ChemComp-EDO / #6: Water | ChemComp-HOH / | |
|---|
-Experimental details
-Experiment
| Experiment | Method:  X-RAY DIFFRACTION / Number of used crystals: 1 X-RAY DIFFRACTION / Number of used crystals: 1 |
|---|
- Sample preparation
Sample preparation
| Crystal | Density Matthews: 2.39 Å3/Da / Density % sol: 48.47 % |
|---|---|
| Crystal grow | Temperature: 277.15 K / Method: vapor diffusion, sitting drop / pH: 6.5 Details: 20% PEG 3350, 0.2 M Na/K tartrate, 0.1 M Bis-Tris propane, pH 6.5, 10% ethylene glycol, VAPOR DIFFUSION, SITTING DROP, temperature 277.15K |
-Data collection
| Diffraction | Mean temperature: 100 K | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Diffraction source | Source:  SYNCHROTRON / Site: SYNCHROTRON / Site:  Diamond Diamond  / Beamline: I03 / Wavelength: 0.9778 Å / Beamline: I03 / Wavelength: 0.9778 Å | |||||||||||||||
| Detector | Type: PSI PILATUS 6M / Detector: PIXEL / Date: Apr 21, 2012 | |||||||||||||||
| Radiation | Monochromator: Si (111) double crystal monochromator / Protocol: SINGLE WAVELENGTH / Monochromatic (M) / Laue (L): M / Scattering type: x-ray | |||||||||||||||
| Radiation wavelength | Wavelength: 0.9778 Å / Relative weight: 1 | |||||||||||||||
| Reflection twin |
| |||||||||||||||
| Reflection | Resolution: 2.049→86.6 Å / Num. all: 103494 / Num. obs: 103422 / % possible obs: 99.5 % / Observed criterion σ(F): 0 / Observed criterion σ(I): 0 / Redundancy: 3.2 % / Biso Wilson estimate: 26.7 Å2 / Rmerge(I) obs: 0.084 / Net I/σ(I): 8.5 | |||||||||||||||
| Reflection shell | Resolution: 2.049→2.16 Å / Redundancy: 2.5 % / Rmerge(I) obs: 0.422 / Mean I/σ(I) obs: 2.1 / Num. unique all: 14756 / % possible all: 97.1 |
- Processing
Processing
| Software |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Refinement | Method to determine structure:  MOLECULAR REPLACEMENT MOLECULAR REPLACEMENTStarting model: PDB ENTRY 3QUE Resolution: 2.049→86.55 Å / Cor.coef. Fo:Fc: 0.965 / Cor.coef. Fo:Fc free: 0.95 / SU B: 4.434 / SU ML: 0.064 / Cross valid method: THROUGHOUT / σ(F): 0 / σ(I): 2 / ESU R: 0.034 / ESU R Free: 0.03 / Stereochemistry target values: MAXIMUM LIKELIHOOD / Details: HYDROGENS HAVE BEEN ADDED IN THE RIDING POSITIONS
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solvent computation | Ion probe radii: 0.8 Å / Shrinkage radii: 0.8 Å / VDW probe radii: 1.2 Å / Solvent model: MASK | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Displacement parameters | Biso mean: 32.418 Å2
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine analyze | Luzzati coordinate error obs: 0.258 Å | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement step | Cycle: LAST / Resolution: 2.049→86.55 Å
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine LS restraints |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS refinement shell | Resolution: 2.049→2.102 Å / Total num. of bins used: 20
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS params. | Method: refined / Refine-ID: X-RAY DIFFRACTION
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS group |
|
 Movie
Movie Controller
Controller
















 PDBj
PDBj


















