+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 4lkt | ||||||
|---|---|---|---|---|---|---|---|
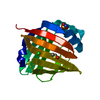
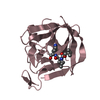
| タイトル | Crystal Structure of Human Epidermal Fatty Acid Binding Protein (FABP5) in Complex with Linoleic Acid | ||||||
 要素 要素 | Fatty acid-binding protein, epidermal | ||||||
 キーワード キーワード | LIPID BINDING PROTEIN / Beta Barrel / Beta Clam / Fatty Acid Binding Protein / Fatty Acids / Nucleus | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報regulation of prostaglandin biosynthetic process / regulation of retrograde trans-synaptic signaling by endocanabinoid / lipid transport across blood-brain barrier / retrograde trans-synaptic signaling by endocannabinoid / positive regulation of peroxisome proliferator activated receptor signaling pathway / negative regulation of D-glucose transmembrane transport / regulation of sensory perception of pain / phosphatidylcholine biosynthetic process / retinoic acid binding / Differentiation of Keratinocytes in Interfollicular Epidermis in Mammalian Skin ...regulation of prostaglandin biosynthetic process / regulation of retrograde trans-synaptic signaling by endocanabinoid / lipid transport across blood-brain barrier / retrograde trans-synaptic signaling by endocannabinoid / positive regulation of peroxisome proliferator activated receptor signaling pathway / negative regulation of D-glucose transmembrane transport / regulation of sensory perception of pain / phosphatidylcholine biosynthetic process / retinoic acid binding / Differentiation of Keratinocytes in Interfollicular Epidermis in Mammalian Skin / Signaling by Retinoic Acid / long-chain fatty acid transmembrane transporter activity / Triglyceride catabolism / epidermis development / postsynaptic cytosol / long-chain fatty acid transport / fatty acid transport / postsynaptic density, intracellular component / secretory granule membrane / fatty acid binding / lipid metabolic process / glucose metabolic process / azurophil granule lumen / glucose homeostasis / positive regulation of cold-induced thermogenesis / postsynaptic density / synapse / lipid binding / Neutrophil degranulation / glutamatergic synapse / extracellular exosome / extracellular region / nucleoplasm / identical protein binding / nucleus / plasma membrane / cytoplasm / cytosol 類似検索 - 分子機能 | ||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 |  X線回折 / X線回折 /  分子置換 / 解像度: 2.57 Å 分子置換 / 解像度: 2.57 Å | ||||||
 データ登録者 データ登録者 | Armstrong, E.H. / Ortlund, E.A. | ||||||
 引用 引用 |  ジャーナル: J.Biol.Chem. / 年: 2014 ジャーナル: J.Biol.Chem. / 年: 2014タイトル: Structural basis for ligand regulation of the fatty acid-binding protein 5, peroxisome proliferator-activated receptor beta / delta (FABP5-PPAR beta / delta ) signaling pathway. 著者: Armstrong, E.H. / Goswami, D. / Griffin, P.R. / Noy, N. / Ortlund, E.A. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  4lkt.cif.gz 4lkt.cif.gz | 124.2 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb4lkt.ent.gz pdb4lkt.ent.gz | 97.6 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  4lkt.json.gz 4lkt.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  4lkt_validation.pdf.gz 4lkt_validation.pdf.gz | 1.2 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  4lkt_full_validation.pdf.gz 4lkt_full_validation.pdf.gz | 1.2 MB | 表示 | |
| XML形式データ |  4lkt_validation.xml.gz 4lkt_validation.xml.gz | 25.5 KB | 表示 | |
| CIF形式データ |  4lkt_validation.cif.gz 4lkt_validation.cif.gz | 32.3 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/lk/4lkt https://data.pdbj.org/pub/pdb/validation_reports/lk/4lkt ftp://data.pdbj.org/pub/pdb/validation_reports/lk/4lkt ftp://data.pdbj.org/pub/pdb/validation_reports/lk/4lkt | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||
| 2 | 
| ||||||||
| 3 | 
| ||||||||
| 4 | 
| ||||||||
| 単位格子 |
| ||||||||
| Components on special symmetry positions |
|
- 要素
要素
-タンパク質 , 1種, 4分子 ABCD
| #1: タンパク質 | 分子量: 15457.715 Da / 分子数: 4 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: FABP5 / プラスミド: pMCSG7 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: FABP5 / プラスミド: pMCSG7 / 発現宿主:  |
|---|
-非ポリマー , 8種, 93分子 












| #2: 化合物 | ChemComp-EIC / #3: 化合物 | ChemComp-GOL / #4: 化合物 | #5: 化合物 | ChemComp-CL / | #6: 化合物 | #7: 化合物 | ChemComp-CIT / | #8: 化合物 | #9: 水 | ChemComp-HOH / | |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 4.03 Å3/Da / 溶媒含有率: 69.47 % |
|---|---|
| 結晶化 | 温度: 277 K / 手法: 蒸気拡散法, ハンギングドロップ法 / pH: 5.6 詳細: 2.4M Ammonium Sulfate, 200mM Na/K Tartrate, 100mM Na Citrate, pH 5.6, VAPOR DIFFUSION, HANGING DROP, temperature 277K |
-データ収集
| 回折 | 平均測定温度: 100 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 放射光源 | 由来:  回転陽極 / タイプ: RIGAKU MICROMAX-007 HF / 波長: 1.5418 Å 回転陽極 / タイプ: RIGAKU MICROMAX-007 HF / 波長: 1.5418 Å | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 検出器 | タイプ: RIGAKU SATURN 944+ / 検出器: CCD / 日付: 2010年6月20日 / 詳細: VariMax | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 放射波長 | 波長: 1.5418 Å / 相対比: 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 反射 | 解像度: 2.57→50 Å / Num. all: 31641 / Num. obs: 31641 / % possible obs: 99.9 % / Observed criterion σ(I): -3 / 冗長度: 9.3 % / Rmerge(I) obs: 0.12 / Χ2: 1.316 / Net I/σ(I): 10.5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 反射 シェル |
|
-位相決定
| 位相決定 | 手法:  分子置換 分子置換 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Phasing MR | Rfactor: 41.83 / Model details: Phaser MODE: MR_AUTO
|
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  分子置換 / 解像度: 2.57→29.357 Å / Occupancy max: 1 / Occupancy min: 0.45 / FOM work R set: 0.736 / SU ML: 0.33 / σ(F): 1.34 / 位相誤差: 31.66 / 立体化学のターゲット値: ML 分子置換 / 解像度: 2.57→29.357 Å / Occupancy max: 1 / Occupancy min: 0.45 / FOM work R set: 0.736 / SU ML: 0.33 / σ(F): 1.34 / 位相誤差: 31.66 / 立体化学のターゲット値: ML
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | 減衰半径: 0.9 Å / VDWプローブ半径: 1.11 Å / 溶媒モデル: FLAT BULK SOLVENT MODEL | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso max: 117.3 Å2 / Biso mean: 47.4269 Å2 / Biso min: 17.65 Å2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 2.57→29.357 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル | Refine-ID: X-RAY DIFFRACTION / Total num. of bins used: 11
|
 ムービー
ムービー コントローラー
コントローラー











 PDBj
PDBj











