| 登録情報 | データベース: PDB / ID: 4l1l
|
|---|
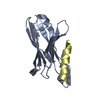
| タイトル | Rat PKC C2 domain bound to CD |
|---|
 要素 要素 | Protein kinase C alpha type |
|---|
 キーワード キーワード | TRANSFERASE / PROTEIN KINASE PKC |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
EGFR Transactivation by Gastrin / HuR (ELAVL1) binds and stabilizes mRNA / Acetylcholine regulates insulin secretion / Depolymerization of the Nuclear Lamina / Signaling by SCF-KIT / Regulation of KIT signaling / Calmodulin induced events / Disinhibition of SNARE formation / SHC1 events in ERBB2 signaling / Response to elevated platelet cytosolic Ca2+ ...EGFR Transactivation by Gastrin / HuR (ELAVL1) binds and stabilizes mRNA / Acetylcholine regulates insulin secretion / Depolymerization of the Nuclear Lamina / Signaling by SCF-KIT / Regulation of KIT signaling / Calmodulin induced events / Disinhibition of SNARE formation / SHC1 events in ERBB2 signaling / Response to elevated platelet cytosolic Ca2+ / Syndecan interactions / positive regulation of angiotensin-activated signaling pathway / response to phorbol 13-acetate 12-myristate / positive regulation of dense core granule biogenesis / cellular response to carbohydrate stimulus / cone photoreceptor outer segment / VEGFR2 mediated cell proliferation / calcium,diacylglycerol-dependent serine/threonine kinase activity / RET signaling / protein kinase C signaling / ooplasm / histone H3T6 kinase activity / central nervous system neuron axonogenesis / desmosome assembly / WNT5A-dependent internalization of FZD4 / RHO GTPases Activate NADPH Oxidases / protein kinase C / diacylglycerol-dependent serine/threonine kinase activity / regulation of platelet aggregation / negative regulation of glial cell apoptotic process / negative regulation of D-glucose import / positive regulation of macrophage differentiation / regulation of muscle contraction / induction of positive chemotaxis / regulation of the force of heart contraction / alphav-beta3 integrin-PKCalpha complex / positive regulation of lipopolysaccharide-mediated signaling pathway / positive regulation of bone resorption / positive regulation of synapse assembly / response to corticosterone / muscle cell cellular homeostasis / positive regulation of cardiac muscle hypertrophy / regulation of synaptic vesicle exocytosis / Trafficking of GluR2-containing AMPA receptors / intercalated disc / peptidyl-threonine phosphorylation / positive regulation of exocytosis / positive regulation of blood vessel endothelial cell migration / chondrocyte differentiation / response to mechanical stimulus / presynaptic cytosol / negative regulation of MAPK cascade / positive regulation of endothelial cell proliferation / neutrophil chemotaxis / positive regulation of smooth muscle cell proliferation / presynaptic modulation of chemical synaptic transmission / positive regulation of endothelial cell migration / positive regulation of cell adhesion / intrinsic apoptotic signaling pathway / negative regulation of insulin receptor signaling pathway / positive regulation of mitotic cell cycle / response to interleukin-1 / calyx of Held / response to reactive oxygen species / stem cell differentiation / establishment of protein localization / response to peptide hormone / mitochondrial membrane / response to toxic substance / integrin binding / positive regulation of angiogenesis / intracellular calcium ion homeostasis / apical part of cell / positive regulation of inflammatory response / response to estradiol / response to ethanol / angiogenesis / learning or memory / cell population proliferation / positive regulation of ERK1 and ERK2 cascade / protein kinase activity / cell adhesion / negative regulation of translation / intracellular signal transduction / positive regulation of cell migration / ciliary basal body / signaling receptor binding / negative regulation of cell population proliferation / axon / protein serine kinase activity / neuronal cell body / protein serine/threonine kinase activity / dendrite / lipid binding / perinuclear region of cytoplasm / enzyme binding / endoplasmic reticulum / protein-containing complex / mitochondrion / zinc ion binding類似検索 - 分子機能 Classical Protein Kinase C alpha, catalytic domain / Protein kinase C, alpha/beta/gamma types / Protein kinase, C-terminal / Protein kinase C terminal domain / Diacylglycerol/phorbol-ester binding / Phorbol esters/diacylglycerol binding domain (C1 domain) / C2 domain / Zinc finger phorbol-ester/DAG-type signature. / Protein kinase C conserved region 2 (CalB) / C2 domain ...Classical Protein Kinase C alpha, catalytic domain / Protein kinase C, alpha/beta/gamma types / Protein kinase, C-terminal / Protein kinase C terminal domain / Diacylglycerol/phorbol-ester binding / Phorbol esters/diacylglycerol binding domain (C1 domain) / C2 domain / Zinc finger phorbol-ester/DAG-type signature. / Protein kinase C conserved region 2 (CalB) / C2 domain / Zinc finger phorbol-ester/DAG-type profile. / Protein kinase C conserved region 1 (C1) domains (Cysteine-rich domains) / Protein kinase C-like, phorbol ester/diacylglycerol-binding domain / C2 domain / C2 domain profile. / C1-like domain superfamily / Extension to Ser/Thr-type protein kinases / AGC-kinase, C-terminal / AGC-kinase C-terminal domain profile. / C2 domain superfamily / Serine/threonine-protein kinase, active site / Serine/Threonine protein kinases active-site signature. / Protein kinase domain / Serine/Threonine protein kinases, catalytic domain / Protein kinase, ATP binding site / Protein kinases ATP-binding region signature. / Protein kinase domain profile. / Protein kinase domain / Protein kinase-like domain superfamily / Immunoglobulin-like / Sandwich / Mainly Beta類似検索 - ドメイン・相同性 |
|---|
| 生物種 |   Rattus norvegicus (ドブネズミ) Rattus norvegicus (ドブネズミ) |
|---|
| 手法 |  X線回折 / X線回折 /  単波長異常分散 / 解像度: 1.6 Å 単波長異常分散 / 解像度: 1.6 Å |
|---|
 データ登録者 データ登録者 | Morales, K.M. / Yang, Y. / Long, Z. / Li, P. / Taylor, A.B. / Hart, P.J. / Igumenova, T.I. |
|---|
 引用 引用 |  ジャーナル: J.Am.Chem.Soc. / 年: 2013 ジャーナル: J.Am.Chem.Soc. / 年: 2013
タイトル: Cd(2+) as a ca(2+) surrogate in protein-membrane interactions: isostructural but not isofunctional.
著者: Morales, K.A. / Yang, Y. / Long, Z. / Li, P. / Taylor, A.B. / Hart, P.J. / Igumenova, T.I. |
|---|
| 履歴 | | 登録 | 2013年6月3日 | 登録サイト: RCSB / 処理サイト: RCSB |
|---|
| 改定 1.0 | 2013年8月28日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2013年10月23日 | Group: Database references |
|---|
| 改定 1.2 | 2024年2月28日 | Group: Data collection / Database references / Derived calculations
カテゴリ: chem_comp_atom / chem_comp_bond ...chem_comp_atom / chem_comp_bond / database_2 / pdbx_struct_conn_angle / struct_conn / struct_site
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession ..._database_2.pdbx_DOI / _database_2.pdbx_database_accession / _pdbx_struct_conn_angle.ptnr1_auth_comp_id / _pdbx_struct_conn_angle.ptnr1_auth_seq_id / _pdbx_struct_conn_angle.ptnr1_label_alt_id / _pdbx_struct_conn_angle.ptnr1_label_asym_id / _pdbx_struct_conn_angle.ptnr1_label_atom_id / _pdbx_struct_conn_angle.ptnr1_label_comp_id / _pdbx_struct_conn_angle.ptnr1_label_seq_id / _pdbx_struct_conn_angle.ptnr2_auth_seq_id / _pdbx_struct_conn_angle.ptnr2_label_asym_id / _pdbx_struct_conn_angle.ptnr3_auth_comp_id / _pdbx_struct_conn_angle.ptnr3_auth_seq_id / _pdbx_struct_conn_angle.ptnr3_label_alt_id / _pdbx_struct_conn_angle.ptnr3_label_asym_id / _pdbx_struct_conn_angle.ptnr3_label_atom_id / _pdbx_struct_conn_angle.ptnr3_label_comp_id / _pdbx_struct_conn_angle.ptnr3_label_seq_id / _pdbx_struct_conn_angle.value / _struct_conn.pdbx_dist_value / _struct_conn.pdbx_ptnr1_label_alt_id / _struct_conn.ptnr1_auth_comp_id / _struct_conn.ptnr1_auth_seq_id / _struct_conn.ptnr1_label_asym_id / _struct_conn.ptnr1_label_atom_id / _struct_conn.ptnr1_label_comp_id / _struct_conn.ptnr1_label_seq_id / _struct_conn.ptnr2_auth_comp_id / _struct_conn.ptnr2_auth_seq_id / _struct_conn.ptnr2_label_asym_id / _struct_conn.ptnr2_label_atom_id / _struct_conn.ptnr2_label_comp_id / _struct_site.pdbx_auth_asym_id / _struct_site.pdbx_auth_comp_id / _struct_site.pdbx_auth_seq_id |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報
 X線回折 /
X線回折 /  単波長異常分散 / 解像度: 1.6 Å
単波長異常分散 / 解像度: 1.6 Å  データ登録者
データ登録者 引用
引用 ジャーナル: J.Am.Chem.Soc. / 年: 2013
ジャーナル: J.Am.Chem.Soc. / 年: 2013 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 4l1l.cif.gz
4l1l.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb4l1l.ent.gz
pdb4l1l.ent.gz PDB形式
PDB形式 4l1l.json.gz
4l1l.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 4l1l_validation.pdf.gz
4l1l_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 4l1l_full_validation.pdf.gz
4l1l_full_validation.pdf.gz 4l1l_validation.xml.gz
4l1l_validation.xml.gz 4l1l_validation.cif.gz
4l1l_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/l1/4l1l
https://data.pdbj.org/pub/pdb/validation_reports/l1/4l1l ftp://data.pdbj.org/pub/pdb/validation_reports/l1/4l1l
ftp://data.pdbj.org/pub/pdb/validation_reports/l1/4l1l リンク
リンク 集合体
集合体
 要素
要素

 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 回転陽極 / タイプ: RIGAKU MICROMAX-007 HF / 波長: 1.54178 Å
回転陽極 / タイプ: RIGAKU MICROMAX-007 HF / 波長: 1.54178 Å 解析
解析 単波長異常分散 / 解像度: 1.6→43.816 Å / Isotropic thermal model: anisotropic / 交差検証法: THROUGHOUT / σ(F): 1.7 / 位相誤差: 17.9 / 立体化学のターゲット値: ML
単波長異常分散 / 解像度: 1.6→43.816 Å / Isotropic thermal model: anisotropic / 交差検証法: THROUGHOUT / σ(F): 1.7 / 位相誤差: 17.9 / 立体化学のターゲット値: ML ムービー
ムービー コントローラー
コントローラー












 PDBj
PDBj













