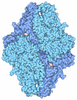
| 登録情報 | データベース: PDB / ID: 4jkm
|
|---|
| タイトル | Crystal Structure of Clostridium perfringens beta-glucuronidase |
|---|
 要素 要素 | - Beta-glucuronidase
- Maltose-binding periplasmic protein
|
|---|
 キーワード キーワード | HYDROLASE / alpha/beta barrel / beta-sandwich / sugar-binding domain / glycosyl hydrolase |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
glucuronoside catabolic process / beta-glucuronidase / beta-glucuronidase activity / beta-galactosidase activity / detection of maltose stimulus / maltose transport complex / carbohydrate transport / carbohydrate transmembrane transporter activity / maltose binding / maltose transport ...glucuronoside catabolic process / beta-glucuronidase / beta-glucuronidase activity / beta-galactosidase activity / detection of maltose stimulus / maltose transport complex / carbohydrate transport / carbohydrate transmembrane transporter activity / maltose binding / maltose transport / maltodextrin transmembrane transport / ATP-binding cassette (ABC) transporter complex, substrate-binding subunit-containing / ATP-binding cassette (ABC) transporter complex / cell chemotaxis / outer membrane-bounded periplasmic space / carbohydrate binding / carbohydrate metabolic process / periplasmic space / DNA damage response / membrane類似検索 - 分子機能 Glycoside hydrolase, family 2, active site / Glycosyl hydrolases family 2 acid/base catalyst. / Glycoside hydrolase, family 2, conserved site / Glycosyl hydrolases family 2 signature 1. / Glycoside hydrolase, family 2 / Glycosyl hydrolases family 2, sugar binding domain / Glycoside hydrolase family 2, catalytic domain / Glycosyl hydrolases family 2, sugar binding domain / Glycosyl hydrolases family 2, TIM barrel domain / Glycoside hydrolase, family 2, immunoglobulin-like beta-sandwich ...Glycoside hydrolase, family 2, active site / Glycosyl hydrolases family 2 acid/base catalyst. / Glycoside hydrolase, family 2, conserved site / Glycosyl hydrolases family 2 signature 1. / Glycoside hydrolase, family 2 / Glycosyl hydrolases family 2, sugar binding domain / Glycoside hydrolase family 2, catalytic domain / Glycosyl hydrolases family 2, sugar binding domain / Glycosyl hydrolases family 2, TIM barrel domain / Glycoside hydrolase, family 2, immunoglobulin-like beta-sandwich / Glycosyl hydrolases family 2 / Beta-Galactosidase/glucuronidase domain superfamily / Galactose-binding domain-like / Maltose/Cyclodextrin ABC transporter, substrate-binding protein / Solute-binding family 1, conserved site / Bacterial extracellular solute-binding proteins, family 1 signature. / Bacterial extracellular solute-binding protein / Bacterial extracellular solute-binding protein / Periplasmic binding protein-like II / Galactose-binding-like domain superfamily / D-Maltodextrin-Binding Protein; domain 2 / Glycosidases / Glycoside hydrolase superfamily / Jelly Rolls / TIM Barrel / Alpha-Beta Barrel / Immunoglobulin-like fold / Immunoglobulins / Immunoglobulin-like / Sandwich / 3-Layer(aba) Sandwich / Mainly Beta / Alpha Beta類似検索 - ドメイン・相同性 Maltose/maltodextrin-binding periplasmic protein / Beta-glucuronidase類似検索 - 構成要素 |
|---|
| 生物種 |   Clostridium perfringens (ウェルシュ菌) Clostridium perfringens (ウェルシュ菌)
  Escherichia coli (大腸菌) Escherichia coli (大腸菌) |
|---|
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 2.263 Å 分子置換 / 解像度: 2.263 Å |
|---|
 データ登録者 データ登録者 | Wallace, B.D. / Redinbo, M.R. |
|---|
 引用 引用 |  ジャーナル: Chem.Biol. / 年: 2015 ジャーナル: Chem.Biol. / 年: 2015
タイトル: Structure and Inhibition of Microbiome beta-Glucuronidases Essential to the Alleviation of Cancer Drug Toxicity.
著者: Wallace, B.D. / Roberts, A.B. / Pollet, R.M. / Ingle, J.D. / Biernat, K.A. / Pellock, S.J. / Venkatesh, M.K. / Guthrie, L. / O'Neal, S.K. / Robinson, S.J. / Dollinger, M. / Figueroa, E. / ...著者: Wallace, B.D. / Roberts, A.B. / Pollet, R.M. / Ingle, J.D. / Biernat, K.A. / Pellock, S.J. / Venkatesh, M.K. / Guthrie, L. / O'Neal, S.K. / Robinson, S.J. / Dollinger, M. / Figueroa, E. / McShane, S.R. / Cohen, R.D. / Jin, J. / Frye, S.V. / Zamboni, W.C. / Pepe-Ranney, C. / Mani, S. / Kelly, L. / Redinbo, M.R. |
|---|
| 履歴 | | 登録 | 2013年3月9日 | 登録サイト: RCSB / 処理サイト: RCSB |
|---|
| 改定 1.0 | 2014年9月17日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2015年10月21日 | Group: Database references |
|---|
| 改定 1.2 | 2024年2月28日 | Group: Data collection / Database references
カテゴリ: chem_comp_atom / chem_comp_bond ...chem_comp_atom / chem_comp_bond / database_2 / struct_ref_seq_dif
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession / _struct_ref_seq_dif.details |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報

 X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  分子置換 / 解像度: 2.263 Å
分子置換 / 解像度: 2.263 Å  データ登録者
データ登録者 引用
引用 ジャーナル: Chem.Biol. / 年: 2015
ジャーナル: Chem.Biol. / 年: 2015 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 4jkm.cif.gz
4jkm.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb4jkm.ent.gz
pdb4jkm.ent.gz PDB形式
PDB形式 4jkm.json.gz
4jkm.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 4jkm_validation.pdf.gz
4jkm_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 4jkm_full_validation.pdf.gz
4jkm_full_validation.pdf.gz 4jkm_validation.xml.gz
4jkm_validation.xml.gz 4jkm_validation.cif.gz
4jkm_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/jk/4jkm
https://data.pdbj.org/pub/pdb/validation_reports/jk/4jkm ftp://data.pdbj.org/pub/pdb/validation_reports/jk/4jkm
ftp://data.pdbj.org/pub/pdb/validation_reports/jk/4jkm リンク
リンク 集合体
集合体

 要素
要素



 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  APS
APS  / ビームライン: 23-ID-D / 波長: 1 Å
/ ビームライン: 23-ID-D / 波長: 1 Å 分子置換
分子置換 解析
解析 分子置換 / 解像度: 2.263→47.791 Å / Occupancy max: 1 / Occupancy min: 0.35 / SU ML: 0.3 / σ(F): 1.33 / 位相誤差: 24.71 / 立体化学のターゲット値: ML
分子置換 / 解像度: 2.263→47.791 Å / Occupancy max: 1 / Occupancy min: 0.35 / SU ML: 0.3 / σ(F): 1.33 / 位相誤差: 24.71 / 立体化学のターゲット値: ML ムービー
ムービー コントローラー
コントローラー














 PDBj
PDBj