| Entry | Database: PDB / ID: 4ibg
|
|---|
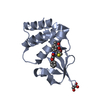
| Title | Ebola virus VP35 bound to small molecule |
|---|
 Components Components | Polymerase cofactor VP35 |
|---|
 Keywords Keywords | TRANSCRIPTION/TRANSCRIPTION inhibitor / interferon inhibitor domain / TRANSCRIPTION-TRANSCRIPTION inhibitor complex |
|---|
| Function / homology |  Function and homology information Function and homology information
symbiont-mediated suppression of host defenses / symbiont-mediated suppression of host RNAi-mediated antiviral immune response / negative regulation of miRNA-mediated gene silencing / symbiont-mediated suppression of host cytoplasmic pattern recognition receptor signaling pathway via inhibition of IKBKE activity / symbiont-mediated suppression of host cytoplasmic pattern recognition receptor signaling pathway via inhibition of IRF7 activity / symbiont-mediated suppression of host antigen processing and presentation of peptide antigen via MHC class II / symbiont-mediated suppression of host PKR/eIFalpha signaling / positive regulation of protein sumoylation / viral transcription / molecular sequestering activity ...symbiont-mediated suppression of host defenses / symbiont-mediated suppression of host RNAi-mediated antiviral immune response / negative regulation of miRNA-mediated gene silencing / symbiont-mediated suppression of host cytoplasmic pattern recognition receptor signaling pathway via inhibition of IKBKE activity / symbiont-mediated suppression of host cytoplasmic pattern recognition receptor signaling pathway via inhibition of IRF7 activity / symbiont-mediated suppression of host antigen processing and presentation of peptide antigen via MHC class II / symbiont-mediated suppression of host PKR/eIFalpha signaling / positive regulation of protein sumoylation / viral transcription / molecular sequestering activity / viral genome replication / viral nucleocapsid / symbiont-mediated suppression of host cytoplasmic pattern recognition receptor signaling pathway via inhibition of TBK1 activity / symbiont-mediated suppression of host toll-like receptor signaling pathway / host cell cytoplasm / symbiont-mediated suppression of host innate immune response / symbiont-mediated suppression of host type I interferon-mediated signaling pathway / negative regulation of gene expression / RNA bindingSimilarity search - Function Filoviridae VP35, C-terminal inhibitory domain, beta-sheet subdomain / Filoviridae VP35, C-terminal inhibitory domain, helical subdomain / Filoviruses VP35 interferon inhibitory domain, beta-sheet subdomain / Filoviridae VP35 protein / Filoviruses VP35 interferon inhibitory domain / Filoviruses VP35 interferon inhibitory domain, helical subdomain / Filoviridae VP35 / Filoviruses VP35 interferon inhibitory domain profile. / Seminal Fluid Protein PDC-109 (Domain B) / Helicase, Ruva Protein; domain 3 ...Filoviridae VP35, C-terminal inhibitory domain, beta-sheet subdomain / Filoviridae VP35, C-terminal inhibitory domain, helical subdomain / Filoviruses VP35 interferon inhibitory domain, beta-sheet subdomain / Filoviridae VP35 protein / Filoviruses VP35 interferon inhibitory domain / Filoviruses VP35 interferon inhibitory domain, helical subdomain / Filoviridae VP35 / Filoviruses VP35 interferon inhibitory domain profile. / Seminal Fluid Protein PDC-109 (Domain B) / Helicase, Ruva Protein; domain 3 / Ribbon / Orthogonal Bundle / Mainly Beta / Mainly AlphaSimilarity search - Domain/homology |
|---|
| Biological species |   Ebola virus Ebola virus |
|---|
| Method |  X-RAY DIFFRACTION / X-RAY DIFFRACTION /  SYNCHROTRON / SYNCHROTRON /  MOLECULAR REPLACEMENT / MOLECULAR REPLACEMENT /  molecular replacement / Resolution: 1.413 Å molecular replacement / Resolution: 1.413 Å |
|---|
 Authors Authors | Brown, C.S. / Leung, D.W. / Xu, W. / Borek, D.M. / Otwinowski, Z. / Ramanan, P. / Stubbs, A.J. / Peterson, D.S. / Binning, J.M. / Amarasinghe, G.K. |
|---|
 Citation Citation |  Journal: J.Mol.Biol. / Year: 2014 Journal: J.Mol.Biol. / Year: 2014
Title: In Silico Derived Small Molecules Bind the Filovirus VP35 Protein and Inhibit Its Polymerase Cofactor Activity.
Authors: Brown, C.S. / Lee, M.S. / Leung, D.W. / Wang, T. / Xu, W. / Luthra, P. / Anantpadma, M. / Shabman, R.S. / Melito, L.M. / Macmillan, K.S. / Borek, D.M. / Otwinowski, Z. / Ramanan, P. / ...Authors: Brown, C.S. / Lee, M.S. / Leung, D.W. / Wang, T. / Xu, W. / Luthra, P. / Anantpadma, M. / Shabman, R.S. / Melito, L.M. / Macmillan, K.S. / Borek, D.M. / Otwinowski, Z. / Ramanan, P. / Stubbs, A.J. / Peterson, D.S. / Binning, J.M. / Tonelli, M. / Olson, M.A. / Davey, R.A. / Ready, J.M. / Basler, C.F. / Amarasinghe, G.K. |
|---|
| History | | Deposition | Dec 8, 2012 | Deposition site: RCSB / Processing site: RCSB |
|---|
| Revision 1.0 | Mar 19, 2014 | Provider: repository / Type: Initial release |
|---|
| Revision 1.1 | May 14, 2014 | Group: Database references |
|---|
| Revision 1.2 | Nov 15, 2017 | Group: Refinement description / Category: software
Item: _software.classification / _software.contact_author ..._software.classification / _software.contact_author / _software.contact_author_email / _software.date / _software.language / _software.location / _software.name / _software.type / _software.version |
|---|
| Revision 1.3 | Jul 17, 2019 | Group: Data collection / Refinement description / Category: software
Item: _software.classification / _software.contact_author ..._software.classification / _software.contact_author / _software.contact_author_email / _software.location / _software.name / _software.type / _software.version |
|---|
| Revision 1.4 | Feb 28, 2024 | Group: Data collection / Database references / Derived calculations
Category: chem_comp_atom / chem_comp_bond ...chem_comp_atom / chem_comp_bond / database_2 / struct_ref_seq_dif / struct_site
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession ..._database_2.pdbx_DOI / _database_2.pdbx_database_accession / _struct_ref_seq_dif.details / _struct_site.pdbx_auth_asym_id / _struct_site.pdbx_auth_comp_id / _struct_site.pdbx_auth_seq_id |
|---|
|
|---|
 Open data
Open data Basic information
Basic information Components
Components Keywords
Keywords Function and homology information
Function and homology information
 X-RAY DIFFRACTION /
X-RAY DIFFRACTION /  SYNCHROTRON /
SYNCHROTRON /  MOLECULAR REPLACEMENT /
MOLECULAR REPLACEMENT /  molecular replacement / Resolution: 1.413 Å
molecular replacement / Resolution: 1.413 Å  Authors
Authors Citation
Citation Journal: J.Mol.Biol. / Year: 2014
Journal: J.Mol.Biol. / Year: 2014 Structure visualization
Structure visualization Molmil
Molmil Jmol/JSmol
Jmol/JSmol Downloads & links
Downloads & links Download
Download 4ibg.cif.gz
4ibg.cif.gz PDBx/mmCIF format
PDBx/mmCIF format pdb4ibg.ent.gz
pdb4ibg.ent.gz PDB format
PDB format 4ibg.json.gz
4ibg.json.gz PDBx/mmJSON format
PDBx/mmJSON format Other downloads
Other downloads https://data.pdbj.org/pub/pdb/validation_reports/ib/4ibg
https://data.pdbj.org/pub/pdb/validation_reports/ib/4ibg ftp://data.pdbj.org/pub/pdb/validation_reports/ib/4ibg
ftp://data.pdbj.org/pub/pdb/validation_reports/ib/4ibg






 Links
Links Assembly
Assembly
 Components
Components










 X-RAY DIFFRACTION / Number of used crystals: 1
X-RAY DIFFRACTION / Number of used crystals: 1  Sample preparation
Sample preparation SYNCHROTRON / Site:
SYNCHROTRON / Site:  APS
APS  / Beamline: 19-ID / Wavelength: 0.979237 Å
/ Beamline: 19-ID / Wavelength: 0.979237 Å molecular replacement
molecular replacement Processing
Processing MOLECULAR REPLACEMENT / Resolution: 1.413→31.759 Å / Cor.coef. Fo:Fc: 0.957 / Cor.coef. Fo:Fc free: 0.944 / Occupancy max: 1 / Occupancy min: 0.5 / SU ML: 0.14 / σ(F): 1.33 / Phase error: 22.99 / Stereochemistry target values: ML / Details: HYDROGENS HAVE BEEN USED IF PRESENT IN THE INPUT
MOLECULAR REPLACEMENT / Resolution: 1.413→31.759 Å / Cor.coef. Fo:Fc: 0.957 / Cor.coef. Fo:Fc free: 0.944 / Occupancy max: 1 / Occupancy min: 0.5 / SU ML: 0.14 / σ(F): 1.33 / Phase error: 22.99 / Stereochemistry target values: ML / Details: HYDROGENS HAVE BEEN USED IF PRESENT IN THE INPUT Movie
Movie Controller
Controller













 PDBj
PDBj