[English] 日本語
 Yorodumi
Yorodumi- PDB-3sra: Structure of Pseudomonas aerugionsa PvdQ covalently acylated with... -
+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 3sra | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Title | Structure of Pseudomonas aerugionsa PvdQ covalently acylated with myristic acid from PVDIq | |||||||||
 Components Components |
| |||||||||
 Keywords Keywords | HYDROLASE / nrps tailoring / acylase | |||||||||
| Function / homology |  Function and homology information Function and homology informationacyl-homoserine-lactone acylase / short-chain fatty acyl-CoA dehydrogenase activity / pyoverdine biosynthetic process / quorum sensing / hydrolase activity, acting on carbon-nitrogen (but not peptide) bonds, in linear amides / bacterial-type flagellum-dependent swarming motility / single-species biofilm formation / antibiotic biosynthetic process / periplasmic space / response to antibiotic ...acyl-homoserine-lactone acylase / short-chain fatty acyl-CoA dehydrogenase activity / pyoverdine biosynthetic process / quorum sensing / hydrolase activity, acting on carbon-nitrogen (but not peptide) bonds, in linear amides / bacterial-type flagellum-dependent swarming motility / single-species biofilm formation / antibiotic biosynthetic process / periplasmic space / response to antibiotic / identical protein binding / cytoplasm Similarity search - Function | |||||||||
| Biological species |  Pseudomonas aeruginosa PAO1 (bacteria) Pseudomonas aeruginosa PAO1 (bacteria) | |||||||||
| Method |  X-RAY DIFFRACTION / X-RAY DIFFRACTION /  SYNCHROTRON / SYNCHROTRON /  MOLECULAR REPLACEMENT / Resolution: 2.3 Å MOLECULAR REPLACEMENT / Resolution: 2.3 Å | |||||||||
 Authors Authors | Gulick, A.M. / Drake, E.J. | |||||||||
 Citation Citation |  Journal: Acs Chem.Biol. / Year: 2011 Journal: Acs Chem.Biol. / Year: 2011Title: Structural Characterization and High-Throughput Screening of Inhibitors of PvdQ, an NTN Hydrolase Involved in Pyoverdine Synthesis. Authors: Drake, E.J. / Gulick, A.M. | |||||||||
| History |
|
- Structure visualization
Structure visualization
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  3sra.cif.gz 3sra.cif.gz | 156.7 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb3sra.ent.gz pdb3sra.ent.gz | 121.5 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  3sra.json.gz 3sra.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/sr/3sra https://data.pdbj.org/pub/pdb/validation_reports/sr/3sra ftp://data.pdbj.org/pub/pdb/validation_reports/sr/3sra ftp://data.pdbj.org/pub/pdb/validation_reports/sr/3sra | HTTPS FTP |
|---|
-Related structure data
| Related structure data |  3l91SC  3l94C  3srbC  3srcC S: Starting model for refinement C: citing same article ( |
|---|---|
| Similar structure data |
- Links
Links
- Assembly
Assembly
| Deposited unit | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| Unit cell |
|
- Components
Components
| #1: Protein | Mass: 17766.896 Da / Num. of mol.: 1 / Fragment: alpha subunit (UNP residues 29-191) Source method: isolated from a genetically manipulated source Source: (gene. exp.)  Pseudomonas aeruginosa PAO1 (bacteria) / Strain: PAO1 / Gene: pvdQ, qsc112, PA2385 / Plasmid: pED485 / Production host: Pseudomonas aeruginosa PAO1 (bacteria) / Strain: PAO1 / Gene: pvdQ, qsc112, PA2385 / Plasmid: pED485 / Production host:  | ||||||
|---|---|---|---|---|---|---|---|
| #2: Protein | Mass: 60489.918 Da / Num. of mol.: 1 / Fragment: beta subunit (UNP residues 217-762) Source method: isolated from a genetically manipulated source Source: (gene. exp.)  Pseudomonas aeruginosa PAO1 (bacteria) / Strain: PAO1 / Gene: pvdQ, qsc112, PA2385 / Plasmid: pED485 / Production host: Pseudomonas aeruginosa PAO1 (bacteria) / Strain: PAO1 / Gene: pvdQ, qsc112, PA2385 / Plasmid: pED485 / Production host:  | ||||||
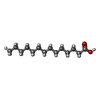
| #3: Chemical | ChemComp-EDO / #4: Chemical | ChemComp-MYR / | #5: Water | ChemComp-HOH / | Has protein modification | Y | |
-Experimental details
-Experiment
| Experiment | Method:  X-RAY DIFFRACTION / Number of used crystals: 1 X-RAY DIFFRACTION / Number of used crystals: 1 |
|---|
- Sample preparation
Sample preparation
| Crystal | Density Matthews: 3 Å3/Da / Density % sol: 58.98 % |
|---|---|
| Crystal grow | Temperature: 293 K / Method: vapor diffusion, hanging drop / pH: 7.5 Details: 10-15% PEG4000, 50-100 mM rubidium chloride, 50 mM HEPES, pH 7.5. Crystal transferred through multiple pH solutions to pH 5.0 for ligand addition, VAPOR DIFFUSION, HANGING DROP, temperature 293K |
-Data collection
| Diffraction | Mean temperature: 113 K |
|---|---|
| Diffraction source | Source:  SYNCHROTRON / Site: SYNCHROTRON / Site:  SSRL SSRL  / Beamline: BL11-1 / Wavelength: 0.97918 Å / Beamline: BL11-1 / Wavelength: 0.97918 Å |
| Detector | Type: MARMOSAIC 325 mm CCD / Detector: CCD / Date: Feb 15, 2011 |
| Radiation | Monochromator: Si(111) / Protocol: SINGLE WAVELENGTH / Monochromatic (M) / Laue (L): M / Scattering type: x-ray |
| Radiation wavelength | Wavelength: 0.97918 Å / Relative weight: 1 |
| Reflection | Resolution: 2.3→29.3 Å / Num. all: 42905 / Num. obs: 42380 / % possible obs: 99.4 % / Observed criterion σ(F): -3 / Observed criterion σ(I): -3 / Biso Wilson estimate: 31.85 Å2 / Rmerge(I) obs: 0.114 / Net I/σ(I): 12 |
| Reflection shell | Resolution: 2.3→2.4 Å / Rmerge(I) obs: 0.352 / Mean I/σ(I) obs: 2.9 / % possible all: 99.8 |
- Processing
Processing
| Software |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Refinement | Method to determine structure:  MOLECULAR REPLACEMENT MOLECULAR REPLACEMENTStarting model: PDB ENTRY 3L91 Resolution: 2.3→29.3 Å / Cor.coef. Fo:Fc: 0.945 / Cor.coef. Fo:Fc free: 0.912 / SU B: 4.923 / SU ML: 0.123 / Cross valid method: THROUGHOUT / σ(F): -3 / ESU R: 0.254 / ESU R Free: 0.194 / Stereochemistry target values: MAXIMUM LIKELIHOOD Details: HYDROGENS HAVE BEEN ADDED IN THE RIDING POSITIONS U VALUES : REFINED INDIVIDUALLY
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solvent computation | Ion probe radii: 0.8 Å / Shrinkage radii: 0.8 Å / VDW probe radii: 1.4 Å / Solvent model: MASK | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Displacement parameters | Biso mean: 27.54 Å2
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement step | Cycle: LAST / Resolution: 2.3→29.3 Å
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine LS restraints |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS refinement shell | Resolution: 2.3→2.359 Å / Total num. of bins used: 20
|
 Movie
Movie Controller
Controller


















 PDBj
PDBj