+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 3gss | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | HUMAN GLUTATHIONE S-TRANSFERASE P1-1 IN COMPLEX WITH ETHACRYNIC ACID-GLUTATHIONE CONJUGATE | ||||||
 要素 要素 | GLUTATHIONE S-TRANSFERASE P1-1 | ||||||
 キーワード キーワード | TRANSFERASE / GLUTATHIONE / PI / DETOXIFICATION / ETHACRYNIC ACID | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報S-nitrosoglutathione binding / nitric oxide storage / negative regulation of smooth muscle cell chemotaxis / negative regulation of leukocyte proliferation / TRAF2-GSTP1 complex / dinitrosyl-iron complex binding / common myeloid progenitor cell proliferation / cellular response to cell-matrix adhesion / hepoxilin biosynthetic process / glutathione derivative biosynthetic process ...S-nitrosoglutathione binding / nitric oxide storage / negative regulation of smooth muscle cell chemotaxis / negative regulation of leukocyte proliferation / TRAF2-GSTP1 complex / dinitrosyl-iron complex binding / common myeloid progenitor cell proliferation / cellular response to cell-matrix adhesion / hepoxilin biosynthetic process / glutathione derivative biosynthetic process / response to L-ascorbic acid / linoleic acid metabolic process / Glutathione conjugation / nitric oxide binding / negative regulation of monocyte chemotactic protein-1 production / JUN kinase binding / glutathione peroxidase activity / oligodendrocyte development / Paracetamol ADME / negative regulation of stress-activated MAPK cascade / negative regulation of JNK cascade / prostaglandin metabolic process / cellular response to glucocorticoid stimulus / negative regulation of interleukin-1 beta production / regulation of stress-activated MAPK cascade / Detoxification of Reactive Oxygen Species / negative regulation of acute inflammatory response / negative regulation of vascular associated smooth muscle cell proliferation / glutathione transferase / glutathione transferase activity / negative regulation of tumor necrosis factor production / protein serine/threonine kinase inhibitor activity / animal organ regeneration / negative regulation of tumor necrosis factor-mediated signaling pathway / response to amino acid / toxic substance binding / regulation of ERK1 and ERK2 cascade / negative regulation of fibroblast proliferation / negative regulation of MAPK cascade / positive regulation of superoxide anion generation / negative regulation of canonical NF-kappaB signal transduction / glutathione metabolic process / xenobiotic metabolic process / cellular response to epidermal growth factor stimulus / fatty acid binding / central nervous system development / response to reactive oxygen species / negative regulation of extrinsic apoptotic signaling pathway / negative regulation of ERK1 and ERK2 cascade / cellular response to insulin stimulus / response to estradiol / cellular response to lipopolysaccharide / vesicle / response to ethanol / secretory granule lumen / ficolin-1-rich granule lumen / Neutrophil degranulation / negative regulation of apoptotic process / negative regulation of transcription by RNA polymerase II / mitochondrion / extracellular space / extracellular exosome / extracellular region / nucleus / cytosol / cytoplasm 類似検索 - 分子機能 | ||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 |  X線回折 / X線回折 /  分子置換 / 解像度: 1.9 Å 分子置換 / 解像度: 1.9 Å | ||||||
 データ登録者 データ登録者 | Oakley, A.J. / Rossjohn, J. / Parker, M.W. | ||||||
 引用 引用 |  ジャーナル: Biochemistry / 年: 1997 ジャーナル: Biochemistry / 年: 1997タイトル: The three-dimensional structure of the human Pi class glutathione transferase P1-1 in complex with the inhibitor ethacrynic acid and its glutathione conjugate. 著者: Oakley, A.J. / Rossjohn, J. / Lo Bello, M. / Caccuri, A.M. / Federici, G. / Parker, M.W. #1:  ジャーナル: J.Mol.Biol. / 年: 1992 ジャーナル: J.Mol.Biol. / 年: 1992タイトル: Three-Dimensional Structure of Class Pi Glutathione S-Transferase from Human Placenta in Complex with S-Hexylglutathione at 2.8 A Resolution 著者: Reinemer, P. / Dirr, H.W. / Ladenstein, R. / Huber, R. / Lo Bello, M. / Federici, G. / Parker, M.W. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  3gss.cif.gz 3gss.cif.gz | 103.5 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb3gss.ent.gz pdb3gss.ent.gz | 78.7 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  3gss.json.gz 3gss.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  3gss_validation.pdf.gz 3gss_validation.pdf.gz | 499.8 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  3gss_full_validation.pdf.gz 3gss_full_validation.pdf.gz | 507.5 KB | 表示 | |
| XML形式データ |  3gss_validation.xml.gz 3gss_validation.xml.gz | 11.2 KB | 表示 | |
| CIF形式データ |  3gss_validation.cif.gz 3gss_validation.cif.gz | 17.5 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/gs/3gss https://data.pdbj.org/pub/pdb/validation_reports/gs/3gss ftp://data.pdbj.org/pub/pdb/validation_reports/gs/3gss ftp://data.pdbj.org/pub/pdb/validation_reports/gs/3gss | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| 単位格子 |
| ||||||||
| 非結晶学的対称性 (NCS) | NCS oper: (Code: given Matrix: (0.938073, 0.148235, 0.313123), ベクター: |
- 要素
要素
-タンパク質 , 1種, 2分子 AB
| #1: タンパク質 | 分子量: 23246.570 Da / 分子数: 2 / 由来タイプ: 組換発現 詳細: COMPLEXED WITH ETHACRYNIC ACID-GLUTATHIONE CONJUGATE 由来: (組換発現)  Homo sapiens (ヒト) / 細胞内の位置: CYTOPLASM / 遺伝子: GSTP1 / 器官: UBIQUITOUS / プラスミド: PGST-1 / 細胞内の位置 (発現宿主): CYTOPLASM / 遺伝子 (発現宿主): GSTP1 / 発現宿主: Homo sapiens (ヒト) / 細胞内の位置: CYTOPLASM / 遺伝子: GSTP1 / 器官: UBIQUITOUS / プラスミド: PGST-1 / 細胞内の位置 (発現宿主): CYTOPLASM / 遺伝子 (発現宿主): GSTP1 / 発現宿主:  |
|---|
-非ポリマー , 5種, 371分子 

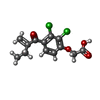






| #2: 化合物 | ChemComp-SO4 / | ||||||
|---|---|---|---|---|---|---|---|
| #3: 化合物 | | #4: 化合物 | #5: 化合物 | #6: 水 | ChemComp-HOH / | |
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.54 Å3/Da / 溶媒含有率: 51.51 % | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 結晶化 | pH: 5.2 / 詳細: pH 5.2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 結晶化 | *PLUS 温度: 22 ℃ / 手法: 蒸気拡散法, ハンギングドロップ法 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶液の組成 | *PLUS
|
-データ収集
| 回折 | 平均測定温度: 100 K |
|---|---|
| 放射光源 | 由来:  回転陽極 / タイプ: RIGAKU RUH2R / 波長: 1.5418 回転陽極 / タイプ: RIGAKU RUH2R / 波長: 1.5418 |
| 検出器 | タイプ: MARRESEARCH / 検出器: IMAGE PLATE / 日付: 1996年7月1日 |
| 放射 | モノクロメーター: GRAPHITE(002) / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長: 1.5418 Å / 相対比: 1 |
| 反射 | 解像度: 1.9→15 Å / Num. obs: 33121 / % possible obs: 90.7 % / Observed criterion σ(I): -1 / 冗長度: 1.8 % / Biso Wilson estimate: 17.1 Å2 / Rmerge(I) obs: 0.088 / Net I/σ(I): 8.7 |
| 反射 シェル | 解像度: 1.9→1.97 Å / 冗長度: 1.7 % / Rmerge(I) obs: 0.271 / Mean I/σ(I) obs: 2.6 / % possible all: 87.3 |
| 反射 | *PLUS Num. measured all: 61022 |
| 反射 シェル | *PLUS % possible obs: 87.3 % |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  分子置換 分子置換開始モデル: PDB ENTRY 1GSS 解像度: 1.9→15 Å / Isotropic thermal model: RESTRAINED INDIVIDUAL / 交差検証法: THROUGHOUT
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 16.3 Å2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 1.9→15 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine LS restraints NCS | NCS model details: RESTRAINTS / Rms dev Biso : 1 Å2 / Rms dev position: 500 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル | 解像度: 1.9→2 Å / Total num. of bins used: 8
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Xplor file |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ソフトウェア | *PLUS 名称:  X-PLOR / バージョン: 3.1 / 分類: refinement X-PLOR / バージョン: 3.1 / 分類: refinement | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 | *PLUS
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル | *PLUS % reflection Rfree: 3.9628 % |
 ムービー
ムービー コントローラー
コントローラー















 PDBj
PDBj








