+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 2xjz | ||||||
|---|---|---|---|---|---|---|---|
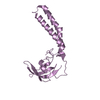
| タイトル | Crystal structure of the LMO2:LDB1-LID complex, C2 crystal form | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード | ONCOPROTEIN / T-CELL LEUKEMIA / PROTO-ONCOGENE / TRANSCRIPTION / DEVELOPMENTAL PROTEIN | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Expression and translocation of olfactory receptors / regulation of kinase activity / cellular component assembly / negative regulation of erythrocyte differentiation / positive regulation of hemoglobin biosynthetic process / cerebellar Purkinje cell differentiation / bHLH transcription factor binding / beta-catenin-TCF complex / transcription-dependent tethering of RNA polymerase II gene DNA at nuclear periphery / epithelial structure maintenance ...Expression and translocation of olfactory receptors / regulation of kinase activity / cellular component assembly / negative regulation of erythrocyte differentiation / positive regulation of hemoglobin biosynthetic process / cerebellar Purkinje cell differentiation / bHLH transcription factor binding / beta-catenin-TCF complex / transcription-dependent tethering of RNA polymerase II gene DNA at nuclear periphery / epithelial structure maintenance / LIM domain binding / gastrulation with mouth forming second / Cardiogenesis / anterior/posterior axis specification / regulation of focal adhesion assembly / cell leading edge / somatic stem cell population maintenance / hair follicle development / positive regulation of cell adhesion / regulation of cell migration / transcription coregulator binding / transcription coregulator activity / positive regulation of transcription elongation by RNA polymerase II / Regulation of expression of SLITs and ROBOs / Wnt signaling pathway / neuron differentiation / nervous system development / RUNX1 regulates transcription of genes involved in differentiation of HSCs / transcription regulator complex / DNA-binding transcription factor binding / RNA polymerase II-specific DNA-binding transcription factor binding / transcription by RNA polymerase II / transcription coactivator activity / cell adhesion / negative regulation of DNA-templated transcription / chromatin binding / chromatin / enzyme binding / negative regulation of transcription by RNA polymerase II / protein homodimerization activity / positive regulation of transcription by RNA polymerase II / protein-containing complex / DNA binding / nucleoplasm / metal ion binding / identical protein binding / nucleus 類似検索 - 分子機能 | ||||||
| 生物種 |  HOMO SAPIENS (ヒト) HOMO SAPIENS (ヒト) | ||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  多波長異常分散 / 解像度: 2.8 Å 多波長異常分散 / 解像度: 2.8 Å | ||||||
 データ登録者 データ登録者 | El Omari, K. / Karia, D. / Porcher, C. / Mancini, E.J. | ||||||
 引用 引用 |  ジャーナル: Blood / 年: 2011 ジャーナル: Blood / 年: 2011タイトル: Structure of the Leukemia Oncogene Lmo2: Implications for the Assembly of a Hematopoietic Transcription Factor Complex. 著者: El Omari, K. / Hoosdally, S.J. / Tuladhar, K. / Karia, D. / Vyas, P. / Patient, R. / Porcher, C. / Mancini, E.J. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  2xjz.cif.gz 2xjz.cif.gz | 327.4 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb2xjz.ent.gz pdb2xjz.ent.gz | 270.7 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  2xjz.json.gz 2xjz.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  2xjz_validation.pdf.gz 2xjz_validation.pdf.gz | 506.8 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  2xjz_full_validation.pdf.gz 2xjz_full_validation.pdf.gz | 520.5 KB | 表示 | |
| XML形式データ |  2xjz_validation.xml.gz 2xjz_validation.xml.gz | 28.5 KB | 表示 | |
| CIF形式データ |  2xjz_validation.cif.gz 2xjz_validation.cif.gz | 39 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/xj/2xjz https://data.pdbj.org/pub/pdb/validation_reports/xj/2xjz ftp://data.pdbj.org/pub/pdb/validation_reports/xj/2xjz ftp://data.pdbj.org/pub/pdb/validation_reports/xj/2xjz | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||
| 2 | 
| ||||||||
| 3 | 
| ||||||||
| 4 | 
| ||||||||
| 5 | 
| ||||||||
| 単位格子 |
|
- 要素
要素
| #1: タンパク質 | 分子量: 15388.909 Da / 分子数: 5 / 断片: RESIDUES 26-156 / 由来タイプ: 組換発現 / 由来: (組換発現)  HOMO SAPIENS (ヒト) / 発現宿主: HOMO SAPIENS (ヒト) / 発現宿主:  #2: タンパク質・ペプチド | 分子量: 3970.351 Da / 分子数: 5 / 断片: RESIDUES 334-368 / 由来タイプ: 組換発現 / 由来: (組換発現)  HOMO SAPIENS (ヒト) / 発現宿主: HOMO SAPIENS (ヒト) / 発現宿主:  #3: 化合物 | ChemComp-ZN / #4: 化合物 | #5: 水 | ChemComp-HOH / | |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.4 Å3/Da / 溶媒含有率: 49 % / 解説: NONE |
|---|---|
| 結晶化 | pH: 5 / 詳細: 1.6 M NACL, 100 MM MES PH5 AND 1 MM DTT |
-データ収集
| 回折 | 平均測定温度: 77 K |
|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  ESRF ESRF  / ビームライン: BM14 / 波長: 1.28226 / ビームライン: BM14 / 波長: 1.28226 |
| 検出器 | タイプ: MARRESEARCH / 検出器: IMAGE PLATE / 日付: 2009年5月15日 |
| 放射 | プロトコル: MAD / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長: 1.28226 Å / 相対比: 1 |
| 反射 | 解像度: 2.8→50 Å / Num. obs: 27216 / % possible obs: 96.7 % / Observed criterion σ(I): 1.8 / 冗長度: 7.3 % / Biso Wilson estimate: 80.34 Å2 / Rmerge(I) obs: 0.14 / Net I/σ(I): 18.8 |
| 反射 シェル | 解像度: 2.8→2.85 Å / 冗長度: 6.3 % / Rmerge(I) obs: 0.84 / Mean I/σ(I) obs: 1.8 / % possible all: 73.2 |
- 解析
解析
| ソフトウェア |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  多波長異常分散 多波長異常分散開始モデル: NONE 解像度: 2.8→48.32 Å / Cor.coef. Fo:Fc: 0.8949 / Cor.coef. Fo:Fc free: 0.8872 / 交差検証法: THROUGHOUT / σ(F): 0 詳細: IDEAL-DIST CONTACT TERM CONTACT SETUP. RESIDUE TYPES WITHOUT CCP4 ATOM TYPE IN LIBRARY=ZN CL. NUMBER OF ATOMS WITH PROPER CCP4 ATOM TYPE=6144. NUMBER WITH APPROX DEFAULT CCP4 ATOM TYPE=0. ...詳細: IDEAL-DIST CONTACT TERM CONTACT SETUP. RESIDUE TYPES WITHOUT CCP4 ATOM TYPE IN LIBRARY=ZN CL. NUMBER OF ATOMS WITH PROPER CCP4 ATOM TYPE=6144. NUMBER WITH APPROX DEFAULT CCP4 ATOM TYPE=0. NUMBER TREATED BY BAD NON-BONDED CONTACTS=22.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 87.85 Å2
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine analyze | Luzzati coordinate error obs: 0.518 Å | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 2.8→48.32 Å
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル | 解像度: 2.8→2.91 Å / Total num. of bins used: 14
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 TLS | 手法: refined / Refine-ID: X-RAY DIFFRACTION
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 TLSグループ |
|
 ムービー
ムービー コントローラー
コントローラー











 PDBj
PDBj




