| 登録情報 | データベース: PDB / ID: 2wzb
|
|---|
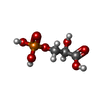
| タイトル | The catalytically active fully closed conformation of human phosphoglycerate kinase in complex with ADP, 3PG and magnesium trifluoride |
|---|
 要素 要素 | PHOSPHOGLYCERATE KINASE 1 |
|---|
 キーワード キーワード | TRANSFERASE / HEREDITARY HEMOLYTIC ANEMIA / PHOSPHOPROTEIN / KINASE / GLYCOLYSIS / NUCLEOTIDE-BINDING |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
negative regulation of pyruvate decarboxylation to acetyl-CoA / Manipulation of host energy metabolism / phosphoglycerate kinase / phosphoglycerate kinase activity / protein-disulfide reductase [NAD(P)H] activity / Gluconeogenesis / canonical glycolysis / Glycolysis / plasminogen activation / epithelial cell differentiation ...negative regulation of pyruvate decarboxylation to acetyl-CoA / Manipulation of host energy metabolism / phosphoglycerate kinase / phosphoglycerate kinase activity / protein-disulfide reductase [NAD(P)H] activity / Gluconeogenesis / canonical glycolysis / Glycolysis / plasminogen activation / epithelial cell differentiation / negative regulation of angiogenesis / gluconeogenesis / glycolytic process / ADP binding / cellular response to hypoxia / transmembrane transporter binding / non-specific serine/threonine protein kinase / mitochondrial matrix / membrane raft / protein serine kinase activity / protein serine/threonine kinase activity / extracellular space / extracellular exosome / ATP binding / metal ion binding / membrane / cytosol類似検索 - 分子機能 Phosphoglycerate kinase, N-terminal domain / Phosphoglycerate kinase / Phosphoglycerate kinase, N-terminal / Phosphoglycerate kinase, conserved site / Phosphoglycerate kinase superfamily / Phosphoglycerate kinase / Phosphoglycerate kinase signature. / Rossmann fold / 3-Layer(aba) Sandwich / Alpha Beta類似検索 - ドメイン・相同性 3-PHOSPHOGLYCERIC ACID / ADENOSINE-5'-DIPHOSPHATE / TRIFLUOROMAGNESATE / Phosphoglycerate kinase 1類似検索 - 構成要素 |
|---|
| 生物種 |  HOMO SAPIENS (ヒト) HOMO SAPIENS (ヒト) |
|---|
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 1.47 Å 分子置換 / 解像度: 1.47 Å |
|---|
 データ登録者 データ登録者 | Bowler, M.W. / Cliff, M.J. / Marston, J.P.M. / Baxter, N.J. / Hownslow, A.M.H. / Varga, A.V. / Szabo, J. / Vas, M. / Blackburn, G.M. / Waltho, J.P. |
|---|
 引用 引用 |  ジャーナル: J.Am.Chem.Soc. / 年: 2010 ジャーナル: J.Am.Chem.Soc. / 年: 2010
タイトル: Transition State Analogue Structures of Human Phosphoglycerate Kinase Establish the Importance of Charge Balance in Catalysis.
著者: Cliff, M.J. / Bowler, M.W. / Szabo, J. / Marston, J.P.M. / Varga, A.V. / Hownslow, A.M.H. / Baxter, N.J. / Blackburn, G.M. / Vas, M. / Waltho, J.P. |
|---|
| 履歴 | | 登録 | 2009年11月27日 | 登録サイト: PDBE / 処理サイト: PDBE |
|---|
| 改定 1.0 | 2010年4月14日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2011年7月13日 | Group: Advisory / Version format compliance |
|---|
| 改定 1.2 | 2011年12月7日 | Group: Database references |
|---|
| 改定 1.3 | 2023年12月20日 | Group: Data collection / Database references ...Data collection / Database references / Derived calculations / Other / Refinement description
カテゴリ: chem_comp_atom / chem_comp_bond ...chem_comp_atom / chem_comp_bond / database_2 / pdbx_database_status / pdbx_initial_refinement_model / pdbx_struct_conn_angle / struct_conn / struct_site
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession ..._database_2.pdbx_DOI / _database_2.pdbx_database_accession / _pdbx_database_status.status_code_sf / _pdbx_struct_conn_angle.ptnr1_auth_comp_id / _pdbx_struct_conn_angle.ptnr1_auth_seq_id / _pdbx_struct_conn_angle.ptnr1_label_asym_id / _pdbx_struct_conn_angle.ptnr1_label_atom_id / _pdbx_struct_conn_angle.ptnr1_label_comp_id / _pdbx_struct_conn_angle.ptnr3_auth_comp_id / _pdbx_struct_conn_angle.ptnr3_auth_seq_id / _pdbx_struct_conn_angle.ptnr3_label_asym_id / _pdbx_struct_conn_angle.ptnr3_label_atom_id / _pdbx_struct_conn_angle.ptnr3_label_comp_id / _pdbx_struct_conn_angle.value / _struct_conn.pdbx_dist_value / _struct_conn.ptnr1_auth_comp_id / _struct_conn.ptnr1_auth_seq_id / _struct_conn.ptnr1_label_asym_id / _struct_conn.ptnr1_label_atom_id / _struct_conn.ptnr1_label_comp_id / _struct_conn.ptnr1_label_seq_id / _struct_conn.ptnr2_auth_comp_id / _struct_conn.ptnr2_auth_seq_id / _struct_conn.ptnr2_label_asym_id / _struct_conn.ptnr2_label_atom_id / _struct_conn.ptnr2_label_comp_id / _struct_conn.ptnr2_label_seq_id / _struct_site.pdbx_auth_asym_id / _struct_site.pdbx_auth_comp_id / _struct_site.pdbx_auth_seq_id |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 HOMO SAPIENS (ヒト)
HOMO SAPIENS (ヒト) X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  分子置換 / 解像度: 1.47 Å
分子置換 / 解像度: 1.47 Å  データ登録者
データ登録者 引用
引用 ジャーナル: J.Am.Chem.Soc. / 年: 2010
ジャーナル: J.Am.Chem.Soc. / 年: 2010 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 2wzb.cif.gz
2wzb.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb2wzb.ent.gz
pdb2wzb.ent.gz PDB形式
PDB形式 2wzb.json.gz
2wzb.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 2wzb_validation.pdf.gz
2wzb_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 2wzb_full_validation.pdf.gz
2wzb_full_validation.pdf.gz 2wzb_validation.xml.gz
2wzb_validation.xml.gz 2wzb_validation.cif.gz
2wzb_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/wz/2wzb
https://data.pdbj.org/pub/pdb/validation_reports/wz/2wzb ftp://data.pdbj.org/pub/pdb/validation_reports/wz/2wzb
ftp://data.pdbj.org/pub/pdb/validation_reports/wz/2wzb リンク
リンク 集合体
集合体
 要素
要素 HOMO SAPIENS (ヒト) / 発現宿主:
HOMO SAPIENS (ヒト) / 発現宿主: 








 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  ESRF
ESRF  / ビームライン: ID14-2 / 波長: 0.933
/ ビームライン: ID14-2 / 波長: 0.933  解析
解析 分子置換
分子置換 ムービー
ムービー コントローラー
コントローラー
















 PDBj
PDBj





