+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 2vzd | ||||||
|---|---|---|---|---|---|---|---|
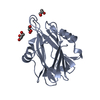
| タイトル | Crystal structure of the C-terminal calponin homology domain of alpha parvin in complex with paxillin LD1 motif | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード | CELL ADHESION / CALPONIN HOMOLOGY DOMAIN / CELL MEMBRANE / METAL-BINDING / CYTOSKELETON / CELL JUNCTION / ACTIN-BINDING / PHOSPHOPROTEIN / MEMBRANE / LD1 MOTIF / LIM DOMAIN | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報actin-mediated cell contraction / smooth muscle cell chemotaxis / establishment or maintenance of cell polarity regulating cell shape / Regulation of cytoskeletal remodeling and cell spreading by IPP complex components / Localization of the PINCH-ILK-PARVIN complex to focal adhesions / Regulation of MITF-M-dependent genes involved in extracellular matrix, focal adhesion and epithelial-to-mesenchymal transition / neuropilin binding / vinculin binding / Cell-extracellular matrix interactions / outflow tract septum morphogenesis ...actin-mediated cell contraction / smooth muscle cell chemotaxis / establishment or maintenance of cell polarity regulating cell shape / Regulation of cytoskeletal remodeling and cell spreading by IPP complex components / Localization of the PINCH-ILK-PARVIN complex to focal adhesions / Regulation of MITF-M-dependent genes involved in extracellular matrix, focal adhesion and epithelial-to-mesenchymal transition / neuropilin binding / vinculin binding / Cell-extracellular matrix interactions / outflow tract septum morphogenesis / signal complex assembly / sprouting angiogenesis / microtubule associated complex / heterotypic cell-cell adhesion / growth hormone receptor signaling pathway / protein kinase inhibitor activity / establishment or maintenance of cell polarity / cilium assembly / Smooth Muscle Contraction / GAB1 signalosome / endothelial cell migration / PTK6 Regulates RHO GTPases, RAS GTPase and MAP kinases / stress fiber / positive regulation of stress fiber assembly / substrate adhesion-dependent cell spreading / transforming growth factor beta receptor signaling pathway / cellular response to reactive oxygen species / beta-catenin binding / VEGFA-VEGFR2 Pathway / Z disc / cell-cell junction / cell migration / lamellipodium / actin cytoskeleton / actin binding / actin cytoskeleton organization / cell cortex / protein phosphatase binding / cell adhesion / protein stabilization / cadherin binding / focal adhesion / signal transduction / metal ion binding / plasma membrane / cytoplasm / cytosol 類似検索 - 分子機能 | ||||||
| 生物種 |  HOMO SAPIENS (ヒト) HOMO SAPIENS (ヒト) | ||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 2.1 Å 分子置換 / 解像度: 2.1 Å | ||||||
 データ登録者 データ登録者 | Lorenz, S. / Vakonakis, I. / Lowe, E.D. / Campbell, I.D. / Noble, M.E.M. / Hoellerer, M.K. | ||||||
 引用 引用 |  ジャーナル: Structure / 年: 2008 ジャーナル: Structure / 年: 2008タイトル: Structural Analysis of the Interactions between Paxillin Ld Motifs and Alpha-Parvin 著者: Lorenz, S. / Vakonakis, I. / Lowe, E.D. / Campbell, I.D. / Noble, M.E.M. / Hoellerer, M.K. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  2vzd.cif.gz 2vzd.cif.gz | 82.8 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb2vzd.ent.gz pdb2vzd.ent.gz | 64.4 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  2vzd.json.gz 2vzd.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  2vzd_validation.pdf.gz 2vzd_validation.pdf.gz | 495.8 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  2vzd_full_validation.pdf.gz 2vzd_full_validation.pdf.gz | 503.1 KB | 表示 | |
| XML形式データ |  2vzd_validation.xml.gz 2vzd_validation.xml.gz | 14.9 KB | 表示 | |
| CIF形式データ |  2vzd_validation.cif.gz 2vzd_validation.cif.gz | 20 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/vz/2vzd https://data.pdbj.org/pub/pdb/validation_reports/vz/2vzd ftp://data.pdbj.org/pub/pdb/validation_reports/vz/2vzd ftp://data.pdbj.org/pub/pdb/validation_reports/vz/2vzd | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2 | 
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 単位格子 |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 非結晶学的対称性 (NCS) | NCSドメイン:
NCSドメイン領域: Ens-ID: 1 / Refine code: 4
NCS oper: (Code: given Matrix: (-0.2002, 0.867, -0.4563), ベクター: |
- 要素
要素
-タンパク質 / タンパク質・ペプチド , 2種, 4分子 ABCD
| #1: タンパク質 | 分子量: 15155.380 Da / 分子数: 2 断片: C-TERMINAL CALPONIN HOMOLOGY DOMAIN, RESIDUES 242-372 由来タイプ: 組換発現 / 由来: (組換発現)  HOMO SAPIENS (ヒト) / プラスミド: PGEX-6P1 / 発現宿主: HOMO SAPIENS (ヒト) / プラスミド: PGEX-6P1 / 発現宿主:  #2: タンパク質・ペプチド | 分子量: 2177.388 Da / 分子数: 2 / 断片: PAXILLIN LD1 MOTIF, RESIDUES 1-20 / 由来タイプ: 合成 / 由来: (合成)  HOMO SAPIENS (ヒト) / 参照: UniProt: P49023 HOMO SAPIENS (ヒト) / 参照: UniProt: P49023 |
|---|
-非ポリマー , 5種, 99分子 








| #3: 化合物 | | #4: 化合物 | #5: 化合物 | #6: 化合物 | ChemComp-EDO / #7: 水 | ChemComp-HOH / | |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.6 Å3/Da / 溶媒含有率: 52.36 % / 解説: NONE |
|---|---|
| 結晶化 | pH: 7.5 / 詳細: 20% (W/V) PEG 10000, 0.1M HEPES PH 7.5 |
-データ収集
| 回折 | 平均測定温度: 100 K |
|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  ESRF ESRF  / ビームライン: ID23-1 / 波長: 0.969 / ビームライン: ID23-1 / 波長: 0.969 |
| 検出器 | タイプ: ADSC CCD / 検出器: CCD / 日付: 2006年11月5日 / 詳細: MIRRORS |
| 放射 | モノクロメーター: SI (111) / プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長: 0.969 Å / 相対比: 1 |
| 反射 | 解像度: 2.1→30.03 Å / Num. obs: 20260 / % possible obs: 98.5 % / Observed criterion σ(I): 2 / 冗長度: 2.9 % / Rmerge(I) obs: 0.05 / Net I/σ(I): 16.4 |
| 反射 シェル | 解像度: 2.1→2.21 Å / 冗長度: 3 % / Rmerge(I) obs: 0.45 / Mean I/σ(I) obs: 2.5 / % possible all: 99.4 |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  分子置換 分子置換開始モデル: PDB ENTRY 2VZC 解像度: 2.1→28.64 Å / Cor.coef. Fo:Fc: 0.945 / Cor.coef. Fo:Fc free: 0.923 / SU B: 12.368 / SU ML: 0.169 / TLS residual ADP flag: LIKELY RESIDUAL / 交差検証法: THROUGHOUT / ESU R: 0.294 / ESU R Free: 0.215 / 立体化学のターゲット値: MAXIMUM LIKELIHOOD / 詳細: HYDROGENS HAVE BEEN ADDED IN THE RIDING POSITIONS.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | イオンプローブ半径: 0.8 Å / 減衰半径: 0.8 Å / VDWプローブ半径: 1.4 Å / 溶媒モデル: MASK | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 43.1 Å2
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 2.1→28.64 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー

















 PDBj
PDBj











