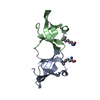
登録情報 データベース : PDB / ID : 2mjvタイトル Solution structures of second bromodomain of Brd4 with di-acetylated Twist peptide Bromodomain-containing protein 4 Twist-related protein 1 キーワード / 機能・相同性 分子機能 ドメイン・相同性 構成要素
/ / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / 生物種 Homo sapiens (ヒト)手法 / Model details lowest energy, model1 データ登録者 Zeng, L. / Zhou, M. ジャーナル : Cancer Cell / 年 : 2014タイトル : Disrupting the Interaction of BRD4 with Diacetylated Twist Suppresses Tumorigenesis in Basal-like Breast Cancer.著者 : Shi, J. / Wang, Y. / Zeng, L. / Wu, Y. / Deng, J. / Zhang, Q. / Lin, Y. / Li, J. / Kang, T. / Tao, M. / Rusinova, E. / Zhang, G. / Wang, C. / Zhu, H. / Yao, J. / Zeng, Y.X. / Evers, B.M. / Zhou, M.M. / Zhou, B.P. 履歴 登録 2014年1月16日 登録サイト / 処理サイト 改定 1.0 2014年3月19日 Provider / タイプ 改定 2.0 2023年11月15日 Group Atomic model / Data collection ... Atomic model / Data collection / Database references / Derived calculations カテゴリ atom_site / chem_comp_atom ... atom_site / chem_comp_atom / chem_comp_bond / database_2 / pdbx_nmr_software / pdbx_nmr_spectrometer / struct_conn Item _atom_site.auth_atom_id / _atom_site.label_atom_id ... _atom_site.auth_atom_id / _atom_site.label_atom_id / _database_2.pdbx_DOI / _database_2.pdbx_database_accession / _pdbx_nmr_software.name / _pdbx_nmr_spectrometer.model / _struct_conn.pdbx_leaving_atom_flag 改定 2.1 2024年11月27日 Group / Structure summaryカテゴリ / pdbx_entry_details / pdbx_modification_featureItem
すべて表示 表示を減らす
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) データ登録者
データ登録者 引用
引用 ジャーナル: Cancer Cell / 年: 2014
ジャーナル: Cancer Cell / 年: 2014 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 2mjv.cif.gz
2mjv.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb2mjv.ent.gz
pdb2mjv.ent.gz PDB形式
PDB形式 2mjv.json.gz
2mjv.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 2mjv_validation.pdf.gz
2mjv_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 2mjv_full_validation.pdf.gz
2mjv_full_validation.pdf.gz 2mjv_validation.xml.gz
2mjv_validation.xml.gz 2mjv_validation.cif.gz
2mjv_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/mj/2mjv
https://data.pdbj.org/pub/pdb/validation_reports/mj/2mjv ftp://data.pdbj.org/pub/pdb/validation_reports/mj/2mjv
ftp://data.pdbj.org/pub/pdb/validation_reports/mj/2mjv リンク
リンク 集合体
集合体
 要素
要素 Homo sapiens (ヒト) / 参照: UniProt: Q15672
Homo sapiens (ヒト) / 参照: UniProt: Q15672 Homo sapiens (ヒト) / 遺伝子: BRD4, HUNK1 / 参照: UniProt: O60885
Homo sapiens (ヒト) / 遺伝子: BRD4, HUNK1 / 参照: UniProt: O60885 試料調製
試料調製 解析
解析 ムービー
ムービー コントローラー
コントローラー












 PDBj
PDBj



 NMRPipe
NMRPipe