+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 2mdu | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | Circular Permutant of the WW Domain with Loop 1 Excised | ||||||
 要素 要素 | Pin1 WW domain | ||||||
 キーワード キーワード | ISOMERASE / Circular Permutation / Miniprotein / Dynamics / Folding | ||||||
| 手法 | 溶液NMR / simulated annealing | ||||||
| Model details | closest to the average, model9 | ||||||
 データ登録者 データ登録者 | Kier, B.L. | ||||||
 引用 引用 |  ジャーナル: J.Am.Chem.Soc. / 年: 2014 ジャーナル: J.Am.Chem.Soc. / 年: 2014タイトル: Circular Permutation of a WW Domain: Folding Still Occurs after Excising the Turn of the Folding-Nucleating Hairpin. 著者: Kier, B.L. / Anderson, J.M. / Andersen, N.H. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
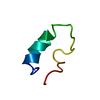
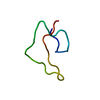
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  2mdu.cif.gz 2mdu.cif.gz | 232.9 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb2mdu.ent.gz pdb2mdu.ent.gz | 193.2 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  2mdu.json.gz 2mdu.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  2mdu_validation.pdf.gz 2mdu_validation.pdf.gz | 393.8 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  2mdu_full_validation.pdf.gz 2mdu_full_validation.pdf.gz | 551.3 KB | 表示 | |
| XML形式データ |  2mdu_validation.xml.gz 2mdu_validation.xml.gz | 22.9 KB | 表示 | |
| CIF形式データ |  2mdu_validation.cif.gz 2mdu_validation.cif.gz | 34 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/md/2mdu https://data.pdbj.org/pub/pdb/validation_reports/md/2mdu ftp://data.pdbj.org/pub/pdb/validation_reports/md/2mdu ftp://data.pdbj.org/pub/pdb/validation_reports/md/2mdu | HTTPS FTP |
-関連構造データ
| 関連構造データ | |
|---|---|
| 類似構造データ | |
| その他のデータベース |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 1 |
| |||||||||
| NMR アンサンブル |
|
- 要素
要素
| #1: タンパク質・ペプチド | 分子量: 3794.395 Da / 分子数: 1 / 由来タイプ: 合成 |
|---|
-実験情報
-実験
| 実験 | 手法: 溶液NMR 詳細: This miniprotein construct represents a circular permutation of the Pin1 WW domain (loop 1 excision), with some additional mutations for stability and removal of chromophore redundancy. The ...詳細: This miniprotein construct represents a circular permutation of the Pin1 WW domain (loop 1 excision), with some additional mutations for stability and removal of chromophore redundancy. The structure is very similar to that of wild-type WW Pin1, except of course for the termini and loop 1. This miniprotein was not designed with native-like ligand-binding function in mind. | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| NMR実験 |
|
- 試料調製
試料調製
| 詳細 | 内容: 50 mM sodium phosphate, 0.5 mM DSS, 90% H2O/10% D2O / 溶媒系: 90% H2O/10% D2O | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 試料 |
| |||||||||
| 試料状態 | イオン強度: 0.11 / pH: 6.5 / 圧: ambient / 温度: 280 K |
-NMR測定
| NMRスペクトロメーター | タイプ: Bruker Avance / 製造業者: Bruker / モデル: AVANCE / 磁場強度: 700 MHz |
|---|
- 解析
解析
| NMR software |
| ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 手法: simulated annealing / ソフトェア番号: 1 / 詳細: Standard Lennard-Jones potential | ||||||||||||||||||||
| NMR constraints | NOE constraints total: 473 / NOE intraresidue total count: 222 / NOE long range total count: 118 / NOE medium range total count: 32 / NOE sequential total count: 101 | ||||||||||||||||||||
| 代表構造 | 選択基準: closest to the average | ||||||||||||||||||||
| NMRアンサンブル | コンフォーマー選択の基準: structures with the lowest energy 計算したコンフォーマーの数: 40 / 登録したコンフォーマーの数: 22 |
 ムービー
ムービー コントローラー
コントローラー













 PDBj
PDBj
