| 登録情報 | データベース: PDB / ID: 2l8x
|
|---|
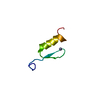
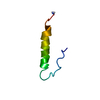
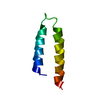
| タイトル | Spatial structure of antimicrobial peptide Arenicin-2 dimer in DPC micelles |
|---|
 要素 要素 | Arenicin-2 |
|---|
 キーワード キーワード | ANTIMICROBIAL PROTEIN / arenicin / oligomerization / beta-hairpin / pore forming peptide |
|---|
| 機能・相同性 | BRICHOS domain / BRICHOS domain / BRICHOS domain profile. / defense response to fungus / killing of cells of another organism / defense response to bacterium / Arenicin-2 機能・相同性情報 機能・相同性情報 |
|---|
| 生物種 |  Arenicola marina (無脊椎動物) Arenicola marina (無脊椎動物) |
|---|
| 手法 | 溶液NMR / simulated annealing |
|---|
| Model details | fewest violations, model 1 |
|---|
 データ登録者 データ登録者 | Shenkarev, Z.O. / Trunov, K.I. / Paramonov, A.S. / Arseniev, A.S. |
|---|
 引用 引用 |  ジャーナル: Biochemistry / 年: 2011 ジャーナル: Biochemistry / 年: 2011
タイトル: Molecular mechanism of action of beta-hairpin antimicrobial peptide arenicin: oligomeric structure in dodecylphosphocholine micelles and pore formation in planar lipid bilayers
著者: Shenkarev, Z.O. / Balandin, S.V. / Trunov, K.I. / Paramonov, A.S. / Sukhanov, S.V. / Barsukov, L.I. / Arseniev, A.S. / Ovchinnikova, T.V. |
|---|
| 履歴 | | 登録 | 2011年1月27日 | 登録サイト: BMRB / 処理サイト: PDBJ |
|---|
| 改定 1.0 | 2011年12月14日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2023年6月14日 | Group: Data collection / Database references / Other
カテゴリ: database_2 / pdbx_database_status ...database_2 / pdbx_database_status / pdbx_nmr_software / pdbx_nmr_spectrometer
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession ..._database_2.pdbx_DOI / _database_2.pdbx_database_accession / _pdbx_database_status.status_code_nmr_data / _pdbx_nmr_software.name / _pdbx_nmr_spectrometer.model |
|---|
| 改定 1.2 | 2024年10月9日 | Group: Data collection / Database references / Structure summary
カテゴリ: chem_comp_atom / chem_comp_bond ...chem_comp_atom / chem_comp_bond / database_2 / pdbx_entry_details / pdbx_modification_feature
Item: _database_2.pdbx_DOI |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Arenicola marina (無脊椎動物)
Arenicola marina (無脊椎動物) データ登録者
データ登録者 引用
引用 ジャーナル: Biochemistry / 年: 2011
ジャーナル: Biochemistry / 年: 2011 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 2l8x.cif.gz
2l8x.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb2l8x.ent.gz
pdb2l8x.ent.gz PDB形式
PDB形式 2l8x.json.gz
2l8x.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード https://data.pdbj.org/pub/pdb/validation_reports/l8/2l8x
https://data.pdbj.org/pub/pdb/validation_reports/l8/2l8x ftp://data.pdbj.org/pub/pdb/validation_reports/l8/2l8x
ftp://data.pdbj.org/pub/pdb/validation_reports/l8/2l8x リンク
リンク 集合体
集合体
 要素
要素 Arenicola marina (無脊椎動物) / 発現宿主:
Arenicola marina (無脊椎動物) / 発現宿主: 
 試料調製
試料調製 解析
解析 ムービー
ムービー コントローラー
コントローラー










 PDBj
PDBj HSQC
HSQC