+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 2k5v | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | SOLUTION NMR STRUCTURE OF the second OB-fold domain of replication protein A from Methanococcus maripaludis. NORTHEAST STRUCTURAL GENOMICS TARGET MrR110B. | ||||||
 要素 要素 | Replication protein A | ||||||
 キーワード キーワード | DNA BINDING PROTEIN / solution NMR structure / replication protein A / OB-fold domain / Structural Genomics / PSI-2 / Protein Structure Initiative / Northeast Structural Genomics Consortium / NESG | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報response to ionizing radiation / double-strand break repair via homologous recombination / DNA binding 類似検索 - 分子機能 | ||||||
| 生物種 |  Methanococcus maripaludis (古細菌) Methanococcus maripaludis (古細菌) | ||||||
| 手法 | 溶液NMR / simulated annealing | ||||||
 データ登録者 データ登録者 | Aramini, J.M. / Maglaqui, M. / Jiang, M. / Ciccosanti, C. / Xiao, R. / Nair, R. / Everett, J.K. / Swapna, G.VT. / Acton, T.B. / Rost, B. ...Aramini, J.M. / Maglaqui, M. / Jiang, M. / Ciccosanti, C. / Xiao, R. / Nair, R. / Everett, J.K. / Swapna, G.VT. / Acton, T.B. / Rost, B. / Montelione, G.T. / Northeast Structural Genomics Consortium (NESG) | ||||||
 引用 引用 |  ジャーナル: To be Published ジャーナル: To be Publishedタイトル: SOLUTION NMR STRUCTURE OF the second OB-fold domain of replication protein A from Methanococcus maripaludis. NORTHEAST STRUCTURAL GENOMICS TARGET MrR110B. 著者: Aramini, J.M. / Maglaqui, M. / Jiang, M. / Ciccosanti, C. / Xiao, R. / Nair, R. / Everett, J.K. / Swapna, G.VT. / Acton, T.B. / Montelione, G.T. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  2k5v.cif.gz 2k5v.cif.gz | 681.8 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb2k5v.ent.gz pdb2k5v.ent.gz | 578.8 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  2k5v.json.gz 2k5v.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  2k5v_validation.pdf.gz 2k5v_validation.pdf.gz | 533.5 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  2k5v_full_validation.pdf.gz 2k5v_full_validation.pdf.gz | 633.5 KB | 表示 | |
| XML形式データ |  2k5v_validation.xml.gz 2k5v_validation.xml.gz | 32.7 KB | 表示 | |
| CIF形式データ |  2k5v_validation.cif.gz 2k5v_validation.cif.gz | 53.8 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/k5/2k5v https://data.pdbj.org/pub/pdb/validation_reports/k5/2k5v ftp://data.pdbj.org/pub/pdb/validation_reports/k5/2k5v ftp://data.pdbj.org/pub/pdb/validation_reports/k5/2k5v | HTTPS FTP |
-関連構造データ
| 類似構造データ | |
|---|---|
| その他のデータベース |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 1 |
| |||||||||
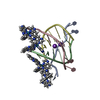
| NMR アンサンブル |
|
- 要素
要素
| #1: タンパク質 | 分子量: 11631.123 Da / 分子数: 1 / 変異: T193A / 由来タイプ: 組換発現 由来: (組換発現)  Methanococcus maripaludis (古細菌) Methanococcus maripaludis (古細菌)生物種: maripaludis / 遺伝子: rpa, MMP1032 / プラスミド: MrR110B-21.1 / 生物種 (発現宿主): coli / 発現宿主:  |
|---|
-実験情報
-実験
| 実験 | 手法: 溶液NMR | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| NMR実験 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NMR実験の詳細 | Text: THE PROTEIN IS MONOMERIC BY GEL FILTRATION CHROMATOGRAPHY, STATIC LIGHT SCATTERING AND 15N T1/T2 RELAXATION. THE STRUCTURE WAS DETERMINED USING TRIPLE RESONANCE NMR SPECTROSCOPY. AUTOMATED ...Text: THE PROTEIN IS MONOMERIC BY GEL FILTRATION CHROMATOGRAPHY, STATIC LIGHT SCATTERING AND 15N T1/T2 RELAXATION. THE STRUCTURE WAS DETERMINED USING TRIPLE RESONANCE NMR SPECTROSCOPY. AUTOMATED BACKBONE ASSIGNMENTS WERE MADE USING AUTOASSIGN, AND THE SIDE CHAIN ASSIGNMENTS WERE COMPLETED MANUALLY. AUTOMATIC NOESY ASSIGNMENTS WERE DETERMINED USING CYANA 2.1. BACKBONE (PHI/ PSI) DIHEDRAL ANGLE CONSTRAINTS WERE OBTAINED FROM TALOS. ROTAMER STATES OF SPECIFIC ORDERED RESIDUES WERE CONSTRAINED IN THE FINAL STAGE OF THE STRUCTURE REFINEMENT BASED ON PROCHECK. COMPLETENESS OF NMR ASSIGNMENTS (EXCLUDING C- TERMINAL HHHHHH): BACKBONE, 100%, SIDE CHAIN, 99.7%, AROMATICS, 100%, STEREOSPECIFIC METHYL, 100%, STEREOSPECIFIC SIDE CHAIN NH2: 100%. FINAL STRUCTURE QUALITY FACTORS (FOR RESIDUES 172 TO 269, PSVS 1.3), WHERE ORDERED RESIDUES [S(PHI) + S(PSI) > 1.8] COMPRISE: 173-204,209-249,254-265: (A) RMSD (ORDERED RESIDUES): BB, 0.6, HEAVY ATOM, 1.0. (B) RAMACHANDRAN STATISTICS FOR ORDERED RESIDUES: MOST FAVORED, 92.4%, ADDITIONALLY ALLOWED, 6.6%, GENEROUSLY ALLOWED, 1.0%, DISALLOWED, 0.0%. (C) PROCHECK SCORES FOR ORDERED RESIDUES (RAW/Z-): PHI-PSI, -0.60/-2.05, ALL, -0.36/-2.13. (D) MOLPROBITY CLASH SCORE (RAW/Z-): 16.29/-1.27 (E) RPF SCORES FOR GOODNESS OF FIT TO NOESY DATA (RESIDUES 172-269): RECALL, 0.990, PRECISION, 0.933, F-MEASURE, 0.961, DP-SCORE, 0.836. (F) NUMBER OF CLOSE CONTACTS PER 20 MODELS: 2. THE C-TERMINAL HIS TAG RESIDUES OF THE PROTEIN (HHHHHH) WERE NOT INCLUDED IN THE STRUCTURE CALCULATIONS AND HAVE BEEN OMITTED FROM THIS DEPOSITION. COORDINATES FOR THE FOLLOWING RESIDUES ARE NOT WELL DETERMINED [S(PHI) + S(PSI) < 1.8]: 172,205-208,250-253, 266-269. |
- 試料調製
試料調製
| 詳細 | 内容: 1.18 MM [U-100% 13C 15N] MRR110B, 20 MM MES, 100 MM SODIUM CHLORIDE, 5 MM CALCIUM CHLORIDE, 10 MM DTT, 0.02 % SODIUM AZIDE, 95% H2O/ 5% D2O; 1.18 MM [U-100% 13C; U -100% 15N] MRR110B, 20 MM ...内容: 1.18 MM [U-100% 13C 15N] MRR110B, 20 MM MES, 100 MM SODIUM CHLORIDE, 5 MM CALCIUM CHLORIDE, 10 MM DTT, 0.02 % SODIUM AZIDE, 95% H2O/ 5% D2O; 1.18 MM [U-100% 13C; U -100% 15N] MRR110B, 20 MM MES, 100 MM SODIUM CHLORIDE, 5 MM CALCIUM CHLORIDE, 10 MM DTT, 0.02 % SODIUM AZIDE, 100% D2O; 0.94 MM [U-5% 13C; U-100% 15N] MRR110B, 20 MM MES, 100 MM SODIUM CHLORIDE, 5 MM CALCIUM CHLORIDE, 10 MM DTT, 0.02 % SODIUM AZIDE, 95% H2O/5% D2O | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 試料 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 試料状態 | イオン強度: 0.1 / pH: 6.5 / 圧: AMBIENT / 温度: 298 K |
-NMR測定
| NMRスペクトロメーター |
|
|---|
- 解析
解析
| NMR software |
| ||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 手法: simulated annealing / ソフトェア番号: 1 詳細: THE FINAL STRUCTURES ARE BASED ON A TOTAL OF 1692 CONFORMATIONALLY-RESTRICTING NOE-DERIVED DISTANCE CONSTRAINTS AND 125 DIHEDRAL ANGLE CONSTRAINTS; 0 HYDROGEN BOND CONSTRAINTS (18.5 ...詳細: THE FINAL STRUCTURES ARE BASED ON A TOTAL OF 1692 CONFORMATIONALLY-RESTRICTING NOE-DERIVED DISTANCE CONSTRAINTS AND 125 DIHEDRAL ANGLE CONSTRAINTS; 0 HYDROGEN BOND CONSTRAINTS (18.5 CONSTRAINTS PER RESIDUE, 6.2 LONG RANGE CONSTRAINTS PER RESIDUE, COMPUTED FOR RESIDUES 172 TO 269 BY PSVS 1.3). STRUCTURE DETERMINATION WAS PERFORMED ITERATIVELY USING CYANA 2.1. THE 20 STRUCTURES OUT OF 100 WITH THE LOWEST TARGET FUNCTION WERE FURTHER REFINED BY RESTRAINED MOLECULAR DYNAMICS/ENERGY MINIMIZATION IN EXPLICIT WATER (CNS) WITH PARAM19. | ||||||||||||||||||||||||||||||||||||||||||||
| NMR constraints | NOE constraints total: 1692 / NOE intraresidue total count: 477 / NOE long range total count: 612 / NOE medium range total count: 170 / NOE sequential total count: 433 / Protein chi angle constraints total count: 4 / Protein other angle constraints total count: 4 / Protein phi angle constraints total count: 58 / Protein psi angle constraints total count: 59 | ||||||||||||||||||||||||||||||||||||||||||||
| NMRアンサンブル | コンフォーマー選択の基準: structures with the lowest energy 計算したコンフォーマーの数: 100 / 登録したコンフォーマーの数: 20 | ||||||||||||||||||||||||||||||||||||||||||||
| NMR ensemble rms | Distance rms dev: 0.01 Å |
 ムービー
ムービー コントローラー
コントローラー










 PDBj
PDBj

 HSQC
HSQC